-
Същност
а) цел - поставянето на важен морален, житейски, граждански или естетически проблем
б) лична позиция - проблемът се разглежда от специфичната лична позиция на автора, която служи като негова основна теза
в) аргументация - в логическа последователност авторът на есето дава своите аргументи в защита на тезата си
г) решение на проблема - от дадените аргументи се прави извод, който служи за решение на разглеждания проблем
-
Структура
а) въведение
- поставя темата на есето
- привлича вниманието на читателя, като го убеждава, че проблемът е важен за него
б) теза
- предлага възможното решение на проблема
- съдържа основното твърдение на автора
в) аргументация
- представя аргументи в полза на тезата
- позовава се на ключови моменти, епизоди и образи от разглежданото произведение
- разпрострира се и върху други литературни примери или области от живота
- примерите засилват аргументите
г) заключение
- оформя се цялостен извод от аргументацията
- обвързват се разглежданият проблем и светът, в който живеем
-
Цел - да се разбере как определен житейски, морален, граждански или естетически проблем е разработен в едно или няколко художествени произведения
-
Структура
а) въведение
- разполага автора на художествения текст и творчеството му в съответния литературно-исторически контекст
- прави преход към конкретния проблем, зададен от заглавието
б) теза - формулира основната идея за това как творбата разработва съответния проблем
в) аргументация
- аргументите се базират само на съответния текст, но не и на други аспекти от живота
- представят се епизодите и персонажите от текста, които най-силни подчертават тезата
- хубаво е да бъде упоменат и историческия контекст на творбата
г) заключение - прави се извод от изложените аргументи, който да препотвърди тезата
-
Изразни средства - използва се по-сдържан език, придържащ се повече към литературната терминология, за да се избегнат двусмислия
-
Обособени части
а) отделящи се със запетая
- разбира се
- напротив
- да речем
- първо, второ, трето
- от една страна, от друга страна
б) неотделящо се със запетая
- според мен, обаче например,може би, навярно, вероятно, като че ли, сякаш, всъщност, впрочем, в крайна сметка
- няма запетая между едносричен съюз и обосебена част
алегория – запечатване на абстрактни, умозрителни идеи в конкретни, предметни образи
Пример: Скелет с коса в ръцете е алегория на смъртта; Лисицата в басните е алегория на хитростта и лукавството.
алитерация – наслагване на един и същ съгласен звук или група съгласни звукове
Пример:
„рани разяждат ранени сърца“
„гарванът грачи грозно, зловещо...“
алюзия – загатване за събитие, творба, герой или митологичен образ, за които се предполага, че са добре известни на читателя
Пример:
"...там цъфти Ханаан От Правдата обетован ..."(„Септември“ Гео Милев)
"Нека Беласица стара и новий Батак в миналото наше фърлят своя мрак..."(Иван Вазов „Опълченците на Шипка)
анафора – повторение в началото на два или повече последователни реда
Пример:
„нека ни отрича историята, века нека е трагично името ни..." (Ив. Вазов „Опълченците на Шипка“)
анжамбман – пренасяне на дума или част от изречение от предходен стих в следващия, при което се получава пауза, несъвпадаща с паузите, произлизащи от синтактичния строеж на изречението
"Немигнал, ставай: ей месец още насред небето, дълбока нощ е ..." („На нивата“ П.К.Яворов)
антитеза – противопоставяне на два противоположни предмета, образа, характеристики, мотиви и други
Пример:
„През деня неуморно изграждам през нощта без пощада руша“ (Димчо Дебелянов „Черна песен“)
апосиопеза – недоизказване на част от изречението или недовършване на мисълта под влияние на силни чувства, което се изразява с многоточие
Пример:
„Но... млъкни сърце!“ ( Христо Ботев „Хаджи Димитър“)
асонанс – наслагване на даден гласен звук или група гласни звукове
Пример:
„настане вечер – месец изгрее“ (Хр. Ботев „Хаджи Димитър“)
градация – натрупване в последователен ред на изразни средства с цел засилване (възходяща градация) или отслабване на чувството (низходяща градация)
Пример:
„една, че две, че три усилни и паметни години...“ (П.К Яворов „Градушка“)
„А тиранинът върлува (…) коли, беси, бие, псува“ (Хр. Ботев „В механата“)
гротеска – художествен похват, чрез който хора и предмети са изобразени в деформиран, карикатурен, преувеличено комичен вид
експозиция – компонент на сюжета: изобразяването на живота на персонажите в периода, който непосредствено предшества завръзката и разгръщането на конфликтите. Различава се от предисторията, в която се съобщават факти от биографията на персонажа и се разказва за миналото му. В експозицията обикновено се представя това, което пряко ще определи следхождащите събития и действия.
елипса – изпускане на дума или част от израз, подразбиращи се по логически път. Обикновено се означава с тире.
Пример:
„Народът – прост Живота – тежък, скучен“ (Н.Вапцаров „Завод“)
епиграф – кратък текст, поместен от автора пред цялото произведение или пред определена негова част. Често пъти чрез него се изразява основен мотив, идея или настроение, които се откриват в основното произведение.
епитет – художествено определение, служещо за допълнителна изразителност и изтъкване на важен, същностен белег.
Пример: мъртва тишина
епифора – повторение в края на стиховете
Пример:
„Вече листата трептят: Отминава! Вече птиците крещят: Отминава!“
етимологична фигура – обединяване в едно словосъчетание на две думи с един и същ корен
Пример:
Бог богува – нека си богува, цар царува – века ли царува?“ (П.К. Яворов „Хайдушки песни“)
инверсия – разместване на частите на изречението с цел определен стилистичен ефект.
Пример: „мъка черна“
ирония – стилистичен похват, при който нещата се изобразяват подигравателно, за да се подчертаят недостатъците на хора или недъзите на обществото чрез приписването на несъществуващи качества, които се подразбират като недостатъци. Тя се свързва с противоречието между това, което се казва, и очакванията или реалността. Ключът към нейното разбиране може да се търси в контекста или в интонацията.
композиция – строежът на произведението, обусловен от фабулата, сюжета, жанра и взаимовръзките между отделните компоненти
литота – преувеличено намаляване на известни признаци или предмети
метафора – тропа, чрез която черти на един предмет се пренасят върху друг въз основата на прилика, свързваща прякото и преносното значение на думите.
Пример:
„робска люлка“, „ръжда разяда глозгани кости“ (Хр.Ботев „Елегия“)
метонимия – заменяне на един предмет с друг поради вътрешна връзка между тях
Пример:
„Талазите идат; всички нащрек са! Последният напън вече е настал!“ (Ив.Вазов „Опълченците на Шипка“)
образен паралелизъм – художествен похват, при който се съпоставят два образа.
Пример:
„Черней, горо, черней, сестро, двама да чернеем - Ти за твойте листи, горо, аз за мойта младост.“ (Народна песен)
олицетворение – приписване на човешки черти на предмети, животни или на природни явления.
Пример:
„А танцуват запалени къщите от безспирния бяг на земята... (Н. Фурнаджиев „Пролетен вятър“)
парадокс – твърдение в противоречие на здравия смисъл; находчив израз като извод или заключение, изграден върху противоположни мисли.
Пример:
„Тоз, който падне в бой за свобода, той не умира...“ (Хр.Ботев „Хаджи Димитър“)
„България... нейният днешен ден е вчера и утре. („Експедиция към идния ден“ Блага Димитрова)
поанта – дума или израз, които обикновено служат за обобщение на смисъла в края на изказване или литературно произведение, с което се подчертава основната мисъл или идея.
Пример:
„и фърляше тайно през мрака тогаз най-първата искра в народната свяст!“ (Ив.Вазов „Паисий“)
ретардация – забавяне на развитието на действието или задържане на разказа. Реализира се чрез въвеждането на допълнителни компоненти: статични описания, лирически отстъпления, вмъкване на предистория, засягаща героя и т.н.
реторичен въпрос – реторичен похват на изразяване; въпрос, който не очаква отговор, а има за цел да привлече вниманието на читателя, да предизвика определен емоционален отклик.
Пример:
„Кой не знае Чавдар войвода? Кой не е чувал за него?“ (Хр.Ботев „Хайдути“)
реторично възклицание – реторична фигура с подчертано възклицателна интонация, изразяваща силно вълнение – възторг, отчаяние, дълбок размисъл или решение, учудване.
Пример:
„Тежко, тежко! Вино дайте!“ (Хр.Ботев „В механата“)
реторично обръщение – реторическа фигура във формата на обръщение, призив, прощаване, изразяващо силно емоционално вълнение.
Пример:
„Балкани, дигайте се в небесата! Обвийте се в бури и мъгли! Ний идем ви на гости със крилата на вашите орли!“ (К.Христов „Хор“)
ретроспекция – връщане назад към миналото на героя или към предишни събития, за да се обяснят конфликти, ситуации в творбата. Тя представлява сюжетно-композиционен похват, който променя потока на времето в сюжетното развитие.
символ – условен познавателен знак за членовете на обществото; предмет, образ или действие, които служат за за условен знак на някакво абстрактно понятие, за някаква идея (например белият цвят символизира невинност); вид художествена образност, при която абстрактната идея се изобразява условно чрез конкретен образ. В Древна Гърция като symbolon определяли двете части на един и същ предмет, които трябвало да се съединят. Оттук и символът се мисли като съединяващ, като плод на съответствията между двата елемента. Символът предполага множество от значения, които той символизира, и това е една от съществените му разлики с метафората и алегорията.
синекдоха – представяне на цял образ чрез негова част
Пример:
„бащино огнище“
синтактичен паралелизъм - Художествен похват, при който се съпоставят успоредно два синтактично еднакви израза, за да се постигне ритмичност и да се поставят акценти. Чрез синтактичния паралелизъм се градират мислите и образите, привлича се вниманието на читателя, разкрива се отношението на автора към поставения проблем.
Пример:
Живот ли бе - да го опишеш? Живот ли бе – да го разровиш? (Н.Вапцаров „История“)
хипербола – преувеличение, реторическа фигура, свързана с преувеличаване на явленията или на определени техни черти с цел постигане на определен стилистичен ефект
Пример:
„...цял век далече са от мен миражите на вчерашния ден.“ (П.Яворов „Душата ми е пуста“)
Алеко Константинов
-
Ранен живот
а) рождение - Свищов, 1. януари 1863г.
б) семейство - Иваница Хаджиконстантинов и фамилията Шишманови
в) образование
- Емануил Васкидович и Янко Мустаков
- Свищовското училище и Априловската гимназия
- Новоросийският университет в Одеса
-
Завръщане в България
а) професионално развитие - заема различни длъжности по софийските съдилища
- уволняван е два пъти по политически причини
б) псевдонимът "Щастливеца"
в) пътешествия
- Всемирното изложение в Париж (1889г.)
- Земското индустриално изложение в Прага (1891г.)
- Колумбовото изложение в Чикаго (1893г.)
г) научна дейност - защитава труд на тема „Правото за помилване по повод на новия наказателен закон“ (1896) с цел да стане преподавател по углавно и гражданско право в Софийския университет
д) обществена и политическа дейност - член на Демократическата партия и много други организации
- основател на първото българско туристическо дружество
е) смърт - убит е при неуспешен атентат срещу съпартиеца му Михаил Такев на 11. май 1897г.
-
Творчество
а) характеристика
- възрожденски дух
- основно изразно средство - хуморът
- висши морални ценности
б) поезия
в) пътеписи - "До Чикаго и назад", "Какво? Швейцария ли?", " В Българска Швейцария"
г) фейлетоните и книгата Бай Ганьо
д) преводаческа дейност - превежда световно известни писатели като Пушкин, Лермонтов, Некрасов, Молиер
Бай Ганьо журналист
-
Жанр - фейлетон
а) жанрови особености на фейлетона
- съчетаване на художествени и публицистични елементи
- хиперболизирано представяне на човешките недостатъци
-
Композиция
а) в началото - приятелска атмосфера сред младите интелигенти
- разказ в разказа - историята на Гедрос за вестника на Бай Ганьо
б) поанта - "Европейци сме ний, ама все не сме дотам" (последното изречение)
- смислово обобщение на цялата книга
-
Герои - Бай Ганьо, Гочоолу, Дочоолу, Данко Харсъзина, Гуньо Адвокатина, Гедро
-
Теми, идеи и мотиви - родното и чуждото
а) контрасти
- Алековата "Весела България" срещу Бай-Баньовата България
б) теми
- патриотизмът като средство за лично облагодетелстване - "Трябва и ние да клъвнем по нещо, току-тъй на сухо патриотизъм – бошлаф"
- политическото хамелеонство
- журналистиката като поле за изява на байганьовщината
в) идеи
- синдромът Бай Ганьо все пак може да бъде надмогнат
Димитър Талев
-
Биография
а) рождение - Прилеп, 1898г.
-
Творчество
а) основни теми
- драматичната и превратна съдба на Македония и българските македонци
б) характерни черти
- ретроспективно вглеждане в емблематични събития и личности от епохата на Възраждането, допринесли за изграждането на националните самосъзние и самочувствие
Железният Светилник
-
История - завършен през септемврти 1946г., което съвпада с принудителното изпращане на Талев в трудовите лагери и затова е публикуван през 1952г.
-
Жанр и структура - роман
а) структура - 4 композиционни дяла, всеки с епиграф, част от народна песен
- "Хаджи Серафимовата внука"
- "В тъмни времена"
- "Народ се пробужда"
- "Корени и гранки"
-
Теми, идеи и конфликти
а) теми
- за родното - представена чрез възрожденския модел за разбиране на родното, основан на езика, етноса и произхода; едновременно идеализиране и огрубяване на родното
- за чуждото - чуждото е възприето като заплаха и се обуславя на етническо и религиозно ниво
- за родоотстъпничеството - някои българи избират да се подчинят на поробителя и асимилаторите гърци, за да се причислят към групата на по-силните
- за извоюването на независима църква
- за изкуството
б) проблеми
- за самосъзнаването и обединението
-
Персонажна система
а) крепители на родовата цялост и семейната чест - Стоян и Султана
б) носители на промяната - Климент Бенков и Лазар Глаушев
- духовни катализатори на промяната - рилският монах и Рафе Клинче
в) потисници на народната общност
- турците - беят, Али, каймаканинът
- гърците - владишкият наместник
- отридителите - Аврам Немтур
Елин Пелин
-
Биография
а) рождение - през 1877г. в с. Байлово
- рождено име - Димитър Иван Стоянов
б) образование - мечтата му е да учи в Рисувателното училище в София, но не е приет
в) кариера
- учител
- библиотекар
- библиотекар в Университетската библиотека
- уредник в литературния музей „Иван Вазов“
- председател на Съюза на българските писатели
- сътрудник в създаването на множество списания.
-
Творчество - "майстор на късия разказ" и "певец на селската неволя"
а) жанрове
- стихотворения
- разкази
- повести
- създава и литература, предназначена за деца
б) основни теми
- за живота на селския човек, осъден непрекъснато да се труди, за да оцелява
- въпреки нерадостната си участ човекът от село съхранява своето жизнелюбие
- пейзажът в творбите му често разкрива идеи, кореспондира с чувствата на героите
"Андрешко"
-
История на творбата
- публикувана за първи път в сп. „Просвета“ през 1903 г. със заглавие „Случка“
- през следващата година попада в сборника „Разкази. Том 1.“ с настоящото си заглавие
- името на героя се превръща в нарицателно за човек, който хитрува и не иска да изпълнява задълженията си към държавата
-
Жанр - къс разказ
-
Композиция
а) завръзка - каруцарят узнава по каква работа е тръгнал съдия-изпълнителят към селото
б) кулминация - Андрешко откарва съдия-изпълнителя в блатото
в) развръзка - съдията остава сам в блатото
г) похвати
- пейзажът и диалогът между героите имат важна роля при изграждането на внушенията на творбата
- чрез разговора между Андрешко и съдия-изпълнителя изпъква противопоставянето между държавните институции и селяните, стоящо в основата на творбата
- пейзажните описания в началото внушават умъртвеност, монотонност и безизходност
- сарказъм и ирония
-
Неща за зубкане - обществото и властта
а) основен конфилкт - между селското съсловие и държавните институции (селото - града, бедност - богатство, изкуствения властови ред - природната същност на човека)
- съдията мисли селяните обобщено и стереотипно като лукави и хитри хора, коварно криещи своите намерения зад простодушна и миловидна обвивка
б) темата за властта
- според съдията - средство, чрез което насилствено и принудително да бъдат изгладени човешките пороци и селяните да бъдат вкарани в правия път
в) темата за бедността
г) идеята за солидарността - съпричастността на Андрешко към неговия съселянин надделява върху държавния закон
д) темата за човека като жертва на държавната власт
е) символи
- "руския камшик" - символ на държавната принуда и властовото насилие
ж) темата за надлъгването
з) темата за невъзможното общуване
и) темата за класовата борба
й) темата за правдата
-
Герои
а) Андрешко
- състрадателен и съпричастен към своите, но що се отнася до кръга на своите.
- ироничен и саркасричен
- неговата постъпка е благородна за едни, а за други – не
- моралният победител в текста
- възприема държавата само като алчно същество, посягащо към последния залък на бедняците
б) съдия-изпълнителят
- представителят на властта, неспособен да изпитва съпричастност
- увит с вълчия си кожух, самият той неусетно приема ролята на вълка – образ на хищничеството, навлязъл от фолклора в социалната литература, където добива смисъла на класов знак – „вълк“ е заможният, тоест грабителят, лошият.
- за него в света има само държава и данъкоплатци, които я мамят.
- беговият език е бюрократичен, агресивен, изключващ друга гледна точка
в) Станоя - той присъства задочно в разказа, но е поводът както за идването на съдията, така и за разгръщането на Андрешковата изобретателност
Иван Вазов
"Паисий"
"О, неразумни юроде! Поради что се срамиш да се наречиш Болгарин?...Или не са имали Болгаре царство и господарство? Ти, Болгарино, не прелщайся, знай свой род и язик..."
Сто и двайсет годин... Тъмнини дълбоки! Тамо вдън горите атонски високи, убежища скрити от лъжовний мир, место за молитва, за отдих и мир, де се чува само ревът беломорски или вечний шепот на шумите горски, ил на звона тежкий набожнийят звън, във скромна килийка, потънала в сън, един монах тъмен, непознат и бледен пред лампа жумеща пишеше наведен.
Що драскаше той там умислен, един? Житие ли ново, нов ли дамаскин, зафанат от дълго, прекъсван, оставян и пред кандилото сред нощ пак залавян? Поличби ли божи записваше там? Слова ли духовни измисляше сам за във чест на някой славен чудотворец, египтянин, елин или светогорец? Що се той мореше с тоя дълъг труд? Ил бе философ? Или беше луд? Или туй канон бе тежък и безумен, наложен на него от строгий игумен?
Най-после отдъхна и рече: "Конец! На житие ново аз турих венец." И той фърли поглед любовен, приветен към тоз труд довършен, подвиг многолетен, на волята рожба, на бденьето плод, погълнал безшумно полвина живот - житие велико! Заради което той забрави всичко, дори и небето! Нивга майка нежна първенеца свой тъй не е гледала, ни младий герой първите си лаври, ни поетът мрачен своят идеал нов, чуден светлозрачен! и кат някой древен библейски пророк ил на Патмос дивний пестинника строг, кога разкривал е въз гладката кожа тайните на мрака и волята божа, той фърли очи си разтреперан, бляд към хаоса тъмний, към звездния свят, към Бялото море, заспало дълбоко, и вдигна тез листи, и викна високо: "От днеска нататък българският род история има и става народ!"
Нека той познае от мойто писанье, че голям е той бил и пак ще да стане, че от славний Будин до светий Атон бил е припознаван нашият закон. Нека всякой брат наш да чете, да помни, че гърците са люде хитри, вероломни, че сме ги блъскали, и не един път - и затуй не можат нази търпят - и че сме имали царства и столици, и от нашта рода светци и патрици; че и ний сме дали нещо на светът и на вси Словене книга да четът; и кога му викат:"Българину!" бесно, той да се гордее с това име честно. Нека наш брат знае, че бог е велик и че той разбира българский язик, че е срам за всякой, който се отрича от своя си рода и при гърци тича и своето име и божия дар зафърля безумно като един твар. Горко вам, безумни, овци заблудени, със гръцка отрова, що сте напоени, дето се срамите от вашия брат и търсите пища в гръцкия разврат, и ругайте грешно бакини си кости, и нашите нрави, че те били прости! Та не вашто племе срам нанася вам, о, безумни люде, а вий сте му срам!
Четете да знайте, що в стари години по тез земи славни вършили деди ни, как със много кралства имали са бран и била велика българската държава; как свети Борис се покръстил в Преслава, как е цар Асен тук храмове градил и дарове пращал; кой бе Самуил, дето си изгуби душата във ада, покори Дурацо и влезе в Елада; четете и знайте кой бе цар Шишман и как нашто царство сториха го плян; кой би Иван Рилски, чийто свети мощи чудеса се славят до тоя ден йоще; как се Крум преславний с Никифора би и из черепа му руйно вино пи и как Симеон цар угрите прогони и от Византия приема поклони. А тоя беше учен, философ велик и не се срамеше от своя език и кога нямаше кого да надвива, той пишеше книги, за да си почива. Четете и знайте, що съм аз писал, от много сказанья и книги събрал, четете, о, братя, да ви се не смеят и вам чужденците да не се гордеят... На ви мойта книга, тя е вам завет, нека де преписва и множи безчет и пръска по всички поля и долини, де българин страда, въздиша и гине. Тя е откровенье, божа благодат - младий прави мъдър, а стария - млад, който я прочита няма да се кае, който знае нея, много ще да знае."
Тъй мълвеше тоз мъж, в килията скрит, със поглед умислен, в бъдещето впит, който много бденья, утринни пропусна, но пачето перо нивга не изпусна и против канонът и черковний звън - работи без отдих, почивка и сън.
Тъй мълвеше преди сто и двайсет годин тоз див Светогорец - за рая негоден, и фърляше тайно през мрака тогаз най-първата искра в народната свяст.
-
Композиция - композиционен център на лирическия цикъл "Епопея на забравените", което може да се смята като препратка към централната роля на самия Паисий в българската история
а) жанр - ода
б) епиграф - откъс от второто „Предисловие“ на Паисиевата „История славянобългарска“, в което монахът се обръща назидателно към отродилите се българи
в) начална част - въвежда образа на атонския монах, погълнат от своето сакрално дело
г) втора част - съдържа призивния монолог на будителя, насочен към неговите сънародници
д) заключителна част - връща читателя в първоначалната лирическа ситуация, изграждайки композиционната рамка на произведението
-
Теми, идеи и мотиви - миналото и паметта
а) контрасти
- мрак <-> светлина - метафорично препращащ към противопоставянето между забравата и паметта, чрез който са изразени ключовите смислови послания в одата
б) теми
- отчуждаването от своя "род и язик"
- загубата на народната идентичност
- необходимостта от познание на собственото минало
в) идеи
- безпаметството и безпросветността - присъстват както през Възраждането, така и в следосвобожденските нагласи
- познаването на миналото като средство за утвърждаване на народното самосъзнание и път към светлото бъдеще
г) мотиви
- отказът от каноничния път към Бога и личното спасение в името на родолюбивата мисия и събуждането на целия народ
д) образи
- мракът
"Новото гробище над Сливница"
Йордан Радичков
-
Биография
а) раждане - през 1929 година в село Калиманица, Монтанско
б) образование
- завършва гимназия в Берковица
в) кариера
- редактор на вестници
- заместник-председател на Съюза на българските писатели
г) смърт - умира на 21. януари 2004г. в София
-
Творчество
"Ноев Ковчег"
-
Композиция
а) жанр - фрагментарен роман
- 13 части, условно наречени "глави"
- липсва традиционен, класически сюжет с общи герои и събития
б) особености
- композиционна рамка - изгражда се от встъпителната („Космическият удавник“) и заключителната част („Небето прокапа“)
- редуват се дълги и къси глави
- редуват се части с последователно разказване и такива с накъсано разказване („разказ в разказа“)
- редуват се разкази с автобиографични мотиви и разкази с митологична стилизация
-
Теми, образи и мотиви
а) образът на Ноевия ковчег - символ на възможността да бъде пренесен споменът през времето и така да бъде съхранен този иначе „въшкав животец“ едновременно в „мизерията и във величествеността му“
- палубата - на нея тече обичайният живот, символизиран от океана
- трюмът - символ на човешкото съзнание, на паметта, съхраняващи близки и далечни спомени, парчета живот, но и парчета човешка мъдрост
б) образът на "космическия удавник" - придава на изображението тайнственост и загадъчност, граничещи с измеренията на кошмарно видение, на халюцинация
- сравнение с митологичния герой Икар - символ на неосъществената дръзка мечта, прекъснатия полет, трагичното крушение на надеждите и копнежите
в) темата за самотата, страданието и отхвърлеността - неизбежни и универсални доминанти в съществуването на всяко едно създание
- зададена чрез образите на прокуденото от своите „въшкарче“ („Въшкарчето“), мършавото куче със завързано дърво на шията („Сивият вълк, черното куче“), старият щъркел със счупено крило, прогонен от отлитащото на юг ято, а на следващата пролет - погубен от събратята си („Щърков сняг“)
г) темата за насилието и жестокостта - също неизбежни
- техен основен носител е човекът - у човека са заложени хищническият инстинкт, кръвожадността и примитивизма („Сивият вълк, черното куче“)
д) темата за "трохите на живота" - изразена чрез крехкото и неусточивото, което Ноевият ковчег има за цел да запази
-
Герои
а) Космическият удавник - трагично въплъщение на безнадеждността и страданието
- чрез него се задава смисловата рамка на повествованието
- паралел с митологичния герой Икар, чието любопитство го води към слънцето
б) Бог и Дявол - Бог сътворява духовните неща, докато земният свят е дяволско творение
- възкресено е древно еретическо вярване
в) хлебарката - дяволско творение, превърнало се в символ на неизтребимия инстинкт за оцеляване
- хлебарките са изразители на разпънатостта между живота (често безсмислен) и смъртта (най-често също безсмислена)
г) въшкарчето, глиганът, щъркелът, лисицата, мишлетата - носят идеята за крехкостта на съществуването
- чрез тяхната съдба се онагледява идеята, че смъртта е единственото сигурно нещо на този свят
д) човекът - представен е като духовно и като природно същество
- човекът е много повече природа, тоест дяволско изчадие, отколкото дух - божествено творение
е) животът като мащеха и смъртта като благодетелка
ж) разказвачът
- око, което е способно да извади от анонимност и най-дребния детайл
- душа, преживяваща различните житейски драми като свои
- разум, осмислящ странните превращения на човешката съдба
- памет, съхраняваща и пренасяща през времето натрупаната мъдрост на човечеството
Никола Вапцаров
-
Биография
а) рождение - 1909г.
- имена - Никола Йонков Вапцаров
б) образование и кариера
- учи в Морското машинно училище във Варна
- работи във фабрика „Българска горска индустрия“ като огняр и като механик
в) забележителности
- арестуван е неколкократно както заради левите си убеждения, така и заради участието си в т.нар. „Соболева акция“
г) смърт - разстреляне на 23. юли 1942 година
-
Творчество
"История"
Какво ще ни дадеш, историйо, от пожълтелите си страници? – Ний бяхме неизвестни хора от фабрики и канцеларии,
ний бяхме селяни, които миришеха на лук и вкиснало, и под мустаците увиснали живота псувахме сърдито.
Ще бъдеш ли поне признателна, че те нахранихме с събития и те напоихме богато с кръвта на хиляди убити.
Ще хванеш контурите само, а вътре, знам, ще бъде празно и няма никой да разказва за простата човешка драма.
Поетите ще са улисани във темпове и във агитки и нашта мъка ненаписана сама в пространството ще скита.
Живот ли бе – да го опишеш? Живот ли бе – да го разровиш? Разровиш ли го – ще мирише и ще горчи като отрова.
По синорите сме се раждали, на завет някъде до тръните, а майките лежали влажни и гризли сухите си бърни.
Като мухи сме мрели есен, жените вили по задушница, изкарвали плача на песен, но само бурена ги слушал.
Онез, които сме оставали, се потехме и под езика, работехме къде що хванем, работехме като добитък.
Мъдруваха бащите в къщи: "Така било е и ще бъде..." А ние плюехме намръщено на оглупялата им мъдрост.
Зарязвахме софрите троснато и търтвахме навън, където една надежда ни докосваше със нещо хубаво и светло.
О, как сме чакали напрегнато в задръстените кафенета! И късно през нощта си легахме с последните комюникета.
О, как се люшкахме в надеждите!... А тегнеше небето ниско, свистеше въздуха нажежен... Не мога повече! Не искам!...
Но в многотомните писания, под буквите и редовете ще вика нашето страдание и ще се зъби неприветно –
защото би ни безпощадно живота с тежките си лапи направо по устата гладни, затуй езика ни е грапав.
И стиховете, дето пишем, когато краднем от съня си, парфюмен аромат не дишат, а са навъсени и къси.
За мъката – не щем награди, не ще дотегнем и с клишета на томовете ти грамади, натрупани през вековете.
Но разкажи със думи прости на тях – на бъдещите хора, които ще поемат поста ни, че ние храбро сме се борили.
-
Композиция
а) жанр - стихотворение
б) стил - емоционално обръщение към историята, реализирано в 1. лице, мн.ч., чрез което лирическият говорител се идентифицира с пренебрегнатите социални маси
в) антитеза - онагледява сблъсъка между две контрастни гледни точки към миналото
- официалната история и на нейните „томове грамади“
- „неизвестните хора“, маргинализирани от историята и изтласкани от разказа за миналото
-
Теми, идеи и мотиви - миналото и паметта
- необективността на историята, която мълчи за страданията на обикновения човек
- историята като средство за изкривяване и подменяне на миналото
- обречеността и непреодолимата безнадеждност на съществуването
- мъчителната агония на еднообразното всекидневие, снизяваща човека до животинското
- разлома между поколенията - бунтът на синовете срещу конформисткото примирение на бащите с установената социална несправедливост
- апел към историята да преодолее своята отчужденост от обикновените, потиснати и обезправени хора
-
Биография
а) рождение - 9. септември 1941г. в София
б) образование
- българска филология - Софийския университет
в) кариера
-
Творчество
а) теми, идеи и мотиви
- изобличаване на абсурдите в нашата социална действителност
- темата за застоя в обществото
- тематя за духовното обезличаване
- идеята за презрението към нравствено извисената личност
б) похвати
- сатира
Балкански синдром
-
Композиция - две действия без обичайните за драматургията компонентни като завръзка, кулминация и развръзка
а) жанр - комедия на нравите
-
Герои - типизиращото назоваване на някои от героите насочва към идеята, че в центъра на изображението стои масовият човек от онова време с присъщите му стереотипни модели на мислене и поведение
а) Директор
- демагог, бюрократ и конформист
- опитва се да режисира ситуацията в началото, като позволява или забранява едно или друго изказване или действие
- в крайна сметка обаче е принуден да се съобразява с нарежданията, давани му от телефона
б) Кумът, бай Цончо, Сватанакът
- символи на "балканщината", простотията и кича
- актуализации на траен народопсихологически тип, наименуван от Алеко Константинов Бай Ганьо
в) Йовчо - предприемчив селянин, облагодетелстващ се от царящия навсякъде дефицит
г) Печо - критикът на бездуховните, който намира оправдания, възпрепятстващи възможността да осъществи своето околсветско пътешествие
д) Жената с проблеми и Жената символ - изразителки на разочарованието от несъвпадението между високите принципи и безрадостната действителност
е) извънземното
- разкрива абсурда на българския свят
- чрез неговите действия другите могат да осъзнаят своето съществуване в застой
ж) Цонка и Георги
з) баба Кера
и) анонимният глас от телефона - препратка към мистичните кукловоди, управляващи живота на цялото българско общество в сянка
-
Теми, идеи и мотиви - родното и чуждото
- невъзможността на официалното изкуство да отрази действителните проблеми и терзания на хората
- разминаването между кухата, официална реторика и житейската практика
- сблъсъкът между масовия вкус на обществото и изтънчените разбирания за изкуство на „елита“
- примитивното отношение към културата
- властващата в обществото статика и невъзможността за изтръгване от застоя
За автора
-
Биография
а) рождение
-
- януари 1848г.
- гр. Калофер
б) образование
- Калофер
- Карлово
- Одеса
в) смърт - 02. юни 1876г. на вр. Вола
-
-
Творчество
а) единствена стихосбирка - "Песни и стихотворения от Ботйова и Съамболова" (1875г.)
- в съавторство със Стефан Стамболов
б) идеи и мотиви
- просвещенски и романтически идеи
- фолклорни образи
"Борба"
-
История на творбата - публикувана за първи път в Ботевия вестник „Дума на българските емигранти“ през 1871 г.
- 1875 г. поетът добавя финалните 10 стиха
-
Жанр и композиция - астрофично стихотворение, съчетаващо елегични и сатирични елементи
а) първа смислова част (1. до 9. стих) - лирическият Аз говори
- за пропиляната си младост („в тъги, в неволи младост минува“)
- за терзанията и яростта си („на душа лежат спомени тежки,/злобна ги памет често повтаря“), породени от невъзможността хората да бъдат изтръгнати от „мъртвешкия сън“ на робството и заблудата
б) втора смислова част (10. до 22. стих)
- обрисуване на преобърнатите в тогавашното общество ценности („свестните у нас считат за луди“)
- изобличаване на социалната несправедливост, поддържана от образите на попа, учителя и журналиста („и на обществен тоя мъчител/и поп, и черква с вяра слугуват; нему се кланя дивак учител“)
в) трета смислова част
- посочване на причините за покорството и апатията
- проциване на "свещената глупост", изречена от
-
Теми, идеи и мотиви
а) идеи
- за робството като духовна категория - поробен, индивидът губи основни човешки ценности (вяра, любов, надежда)
- за "свещената глупост" („Бой се от бога, почитай царя“), изречена от Соломон, която заставя хората пасивно да понасят страданията и несправедливостите
б) контрасти - текстът изобилства от оксиморони
- мъдрост-глупост
- истина-лъжа
- човек-скот
- разум-лъжлива вяра;
- прогрес-сън
-
Герои
а) лирическият Аз
- следва просвещенските идеи
- борец за социална справедливост
- бунтува се срещу догмите и лъжите
- критикува първоизточниците на робството- инертността на духа, битовата рутина, неосъзнатата уседналост и навика
- пародира насърчаващото към покорство християнско смирение
б) тираните
- попът, учителят и вестникаринът съдействат на обществения мъчител
- използват библейските постулати, за да заставят хората към покорство
- част от тях са и интелигенция, която учи хората на наивно смирение
в) жертвите
- лирическият Аз изпитва съжаление към тях, но не оправдава тяхното бездействие - те също трябва да носят отговорност за своята ситуация
- духовно незрели
- слушат лъжите на властниците и им вярвар слепешки
"До моето първо либе"
-
История на творбата
- публикувано за първи път на 22. юни 1871 г. във вестник „Дума на българските емигранти“
-
Композиция
а) жанр - лирическо стихотворение, с елементи на елегия
б) композиционен план - 9 строфи
- от 1. до 3. строфа - лирическият говорител отхвърля някогашните любовни заблуди, разпознати като „отрова“ и като болезнен спомен от миналото
- от 4. до 6. строфа - разгръща се картината на робското настояще чрез призива на лирическия аз към либето да се вслуша в народните стенания
- от 7. до 9. строфа - представят се естетизираната смърт и желанието на героя да жертва себе си в името на своя идеал
в) похвати
- изповеден характер
- много глаголи в повелително наклонение - "запей", "млъкни", "махни се", "забрави"
-
Теми, проблеми и конфликти
а) темата за човешката активност
б) темата за любовта и човешкото интимно споделяне
в) мотивът за песента
г) мотивът за погубената младост
д) темата за живота и смъртта
Христо Смирненски
-
Биография
а) рождение - 17. септември 1898г. в гр. Кукуш
- рождено име - Христо Димитров Измирлиев
б) образование
- завършва в София
- записва се във Военното училище през 1917г., но година по-късно го напуска
в) кариера - работи от малък поради финансовите затруднения на семейството му
- вестникар
- продавач
- редактор
- репортер
г) политическа дейност
- член на Комунистическия младежки съюз (от 1920г.)
- член на Комунистическата партия (от 1921г.)
д) смърт - умира през 1923г. от туберкулоза в София
-
Творчество
а) характеристики
- постсимволизъм
- поставя проблемите за социално неравенство, за преосмислянето на социалния ред, за утопичното бъдеще
б) хронология
- първа стихосбирка- „Разнокалибрени въздишки в стихове и проза“ (1918г.)
- втора стихосбирка - ""
"Приказка за стълбата"
-
История на творбата
- публикувана на 25. май 1923г. в сп. "Младеж"
- последната творба на Смирненски
-
Жанр - разказ с белези на фейлетон
-
Композиция
а) епиграф
- адресиран към съвестта на читателите и насочващ към проблема за самопознанието и автоидентификацията
б) особености
- симетрична компизиция - краят отразява началото, но с преобърнат смисъл
- диалог между Дявола и младежа
-
Герои
а) момъкът (юноша)
- дръзновен, готов да отмъсти за несправедливия обществен ред
- тръгва от социалните низини с най-чисти идеали, но изкачвайки се по обществената стълбица, постепенно губи себе си
б) Дяволът
- не е християнската представа за абсолютно зло
- изразител на тъмната, компромисната страна от личността на юношата
- чрез него се изважда на показ човешката слабост на младежа
- провокатор, катализатор на онова, което бездруго е заложено у момъка.
в) патрициите
- князете, пируващи във висините
- пребивават в свят, потънал в разврат и фалш
-
Неща за зубкане
а) контрасти
- горе-долу - пространството "горе" е мястото на безметежното щастие на бездушните принцове и князе, а „долу“ – мястото на социалното угнетение и огорчение
- мизерия-богатство
- добро-зло
б) теми
- темата за идентичността
- темата за обществото и властта
- темата за сделката с Дявола - и най-доброто намерение, и най-високата мисия може да се загубят по пътя към върховете на властта, когато този път се подчинява на правилото „целта оправдава средствата“
в) алегории
- сделката с Дявола
- загубата на човешките сетива - загубата на идентичността
-
Числова редица - функция , където или
а) крайна числова редица - числова редица , където
- означение:
б) безкрайна числова редица - числова редица , където
- означение:
-
Задаване на числова редица
а) чрез изреждане - за крайни числови редици
б) описателно - чрез думи
в) аналитично
- чрез формула за -тия член
- чрез рекурентна връзка - зависимост от предишните членове
-
Монотонност - свойството на членовете на дадена редица винаги или да намаляват или да нарастват
а) монотонно растяща редица
- нестрого:
- строго:
б) монотонно намаляваща редица
- нестрого:
- строго:
-
Ограниченост
а) ограниченост отгоре - числовата редица е ограничена отгоре, ако съществува число такова, че
- всяка ограничена отгоре редица има безброй много горни граници (всички числа )
б) ограниченост отдолу - числовата редица е ограничена отгоре, ако съществува число такова, че
- всяка ограничена отдолу редица има безброй много долни граници (всички числа )
в) ограниченост - числовата редица е ограничена, ако е ограничена отдолу и ограничена отгоре
-
Граница - числото се нарича граница на безкрайната числова редица , ако съществува число такова, че
а) означение
-
Сходяща редица - една числова редица е сходяща, ако има граница
а) критерии за сходяща редица
- всяка монотонно растяща редица, която е ограничена отгоре, има граница
- всяка монотонно намаляваща редица, която е ограничена отдолу, има граница
- ако разликата между които и да е два последователни члена на редицата клони към нула, то редицата е сходяща
- лема за двамата полицай - ако и за редицата е изпълнено, че , то
- ако е монотонно растяща, а е монотонно намаляваща , и е изпълнено, че , то двете редици са сходящи
б) критерии за ограниченост
- всяка сходяща редица е ограничена
-
Свойства на граници - за сходящите редици и
-
Редица, клоняща към безкрайност
Безкрайността не се счита за граница.
а) към плюс безкрайност - безкрайната редица клони към , ако такова, че
- запис
б) към минус безкрайност - безкрайната редица клони към , ако такова, че
- запис
-
Неопреленост - форма на граница, която може да се получи при граничен преход
В този случай не се знае дали редицата има граница и трябва да се търси друг начин за установяването на такава.
-
Неперово число
а) следствия
-
Геометрична прогресия - числова редица от следния вид
а) частно на прогресията - числото
б) връзка с първия член
-
Сбор на членовете на геометрична прогресия
а) сбор на първите члена
б) сума на безкрайна геометрична прогресия - съществува само когато
-
Полином на една променлива - израз от следния вид
а) степен на полинома () - най-високата степен на , която има ненулев коефициент в полинома
б) старши коефициент - коефициентът пред най-високата степен на
в) свободен член - коефициентът пред нулевата степен на
- равен е на стойността на полинома при
-
Деление на полиноми - всеки полином може да се представи еднозначно в следната форма
а) делимо - полиномът
б) делител - полиномът
в) частно - полиномът
г) остатък - полиномът
-
Корен (нула) на полином - числото се нарича корен (нула) на полинома , когато
а) брой корени - всеки полином от степен има най-много различни корена
Теорема:
Числото е корен на полинома тогава и само тогава, когато се дели на .
Доказателство: Ако се дели на , то и при се получава . Ако е нула на , то се превръща във при и следователно остатъкът трябва да е нула.
б) кратност на корена - числото е -кратен корен на полинома , ако и
-
Тъждественост на полиноми - ако два полинома на една променлива от степен имат еднакви стойности за различни стойности на променливата, то те са тъждествено равни
-
Схема на Хорнер - метод за бързо делене на произволен полином на полином от вида
Нека и . Тогава полиномът може да представи по следния начин, където е константа, защото степента му е по-малка от степента на делителя :
Коефициентите на и остатъкът се намират като се извършат действията в следната таблица
-
Теорема на Безу - остатъкът при делението на полинома с е равен на стойността на полинома за , т.е. .
а) доказателство
-
Преобразуване на полиноми
а) от нормален вид във вид на степени на
- търсят се коефициентите
- изваждаме пред скоби
- следователно е остатъкът при делението на на
- по същия начин, чрез повторено изваждане на пред скоби се намират и останалите коефициенти - общо деления
- това може да се направи бързо чрез схемата на Хорнер
б) от вид на степени на във нормален вид
- търсят се коефициентите
- полагаме
- следователно \begin{align}A(x-p) = A(t) &= a_n(t+p)^n + a_{n-1}(t+p)^{n-1} + \cdots + a_1(t+p) + a_0 \&= a_n't^n + a_{n-1}'t^{n-1} + \cdots + a_1't + a_0'\end{align}
- задачата се свежда до представянето на полинома по степени на
-
Намиране на рационални корени на полиноми - ако полиномът има рационални корени, т.е. корени от вида (където ), то числителят е делител на свободния член , а знаменателят е делител на старшия коефициент
Доказателство:
Умножаваме двете страни по .
Събираемите с коефициенти до очевидно се делят на . Тъй като се дели на , то последното събираемо също трябва да се дели на . Тъй като и са взаимно прости, трябва да е делител на . Аналогично за и събираемите с коефициенти до включително
а) отсяване на кандидати за корени - ако несъкратимата дроб е корен на полинома , то за всяко число е вярно, че
- ако дадено число не спазва това свойство, то не може да бъде корен на полинома
-
Решаване на реципрочни уравнения от четна степен (РУЧС) - полином с цели коефициенти от следния вид, където е някакво цяло число
а) разпознаване на РУЧС
- разликата в индексите на първите коефициента и степента на е винаги равна на
- първо се намира средния член в полинома
- коефициентите вдясно от средния член се разлагат на множители и се гледа дали съдържат последователни степени на даден общ множител
- гледа се дали произдведението на останалите множители на всеки коефициент вдясно (т.е. без степените на ) съвпадат с коефициента на огледалния член спрямо средния член
б) корени на РУЧС
- числото 0 никога не е корен на дадено РУЧС
- ако е корен на дадено РУЧС, то също е корен на въпросното РУЧС
в) решаване на РУЧС
- членовете с огледални коефициенти се групират
- разделя се на
- полага се
- останалите скоби се изразяват като се вдига на съответната степен
г) симетрично РУЧС:
- коефициентите отляво и отдясно на средния член съвпата напълно с огледалните си
-
Решаване на реципрочни уравнения от нечетна степен (РУНС) - полином с цели коефициенти от следния вид, където е някакво цяло число
а) разпознаване на РУНС
- коефициентите във втората половина от полинома отговарят огледално на коефициентите от първата половина, но умножение по последователни нечетни степени на
б) корени на РУНС
- числото 0 никога не е корен на дадено РУНС
- числото винаги е корен на дадено РУНС
в) решаване на РУНС - свеждане до РУЧС
- уравнението се разлага в следния вид, защото винаги е корен
- полиномът е гарантиран да бъде РУЧС от степен и вече се използва метода за решаване на РУЧС
г) симетрично РУНС:
- коефициентите в лявата половината и в дясната половина на полинома съвпадат напълно огледално
-
Уравнения от вида
а) решаване - чрез полагане на
-
Нютонов бином - нормалният вид на многочлена
а) свойства
- броят на едночлените в Нютоновия бином е
- ако е четно (), то най-големият коефициент е средният ()
- ако е нечетно (), то двата средни коефициента са най-големи ()
- сборът на всички коефициенти е
- сборът от четните коефициенти е равен на сбора от нечетните коефициенти (
-
Пермутация - начин на подреждане на елемента, които се смятат за различни един от друг
а) брой пермутации ()
-
Вариация от елемента -ти клас - всяко подмножество от елемента на множество от елемента, като се отчита редът на задаване на елементите в подмножеството
а) брой вариации ()
-
Комбинация от елемента -ти клас - всяко подмножество от елемента на множество от елемента, като не се отчита редът на задаване на елементите в подмножеството
а) брой комбинации ()
б) свойства
-
Елементарно събитие - всеки отделен възможен изход от един опит се нарича елементарно събитие
-
Достоверно (сигурно) събитие - събитие, което винаги се случва
-
Невъзможно събитие - събитие, което никога не се случва
-
Пълна система от елементарни събития - множеството от всички възможни елементарни събития на един опит
а) случайно събитие - подмножество на пълната система от елементарни събития
б) сложно събитие - случайно събитие с повече от един елемента
-
Вероятност на случайно събитие - мярка, оценяваща възможността за реализиране на случайно събитие
-
Елипса - геометрично място от точки, за които сборът от разстоянията от всяка такава точка до две предварително избрани точки е константа
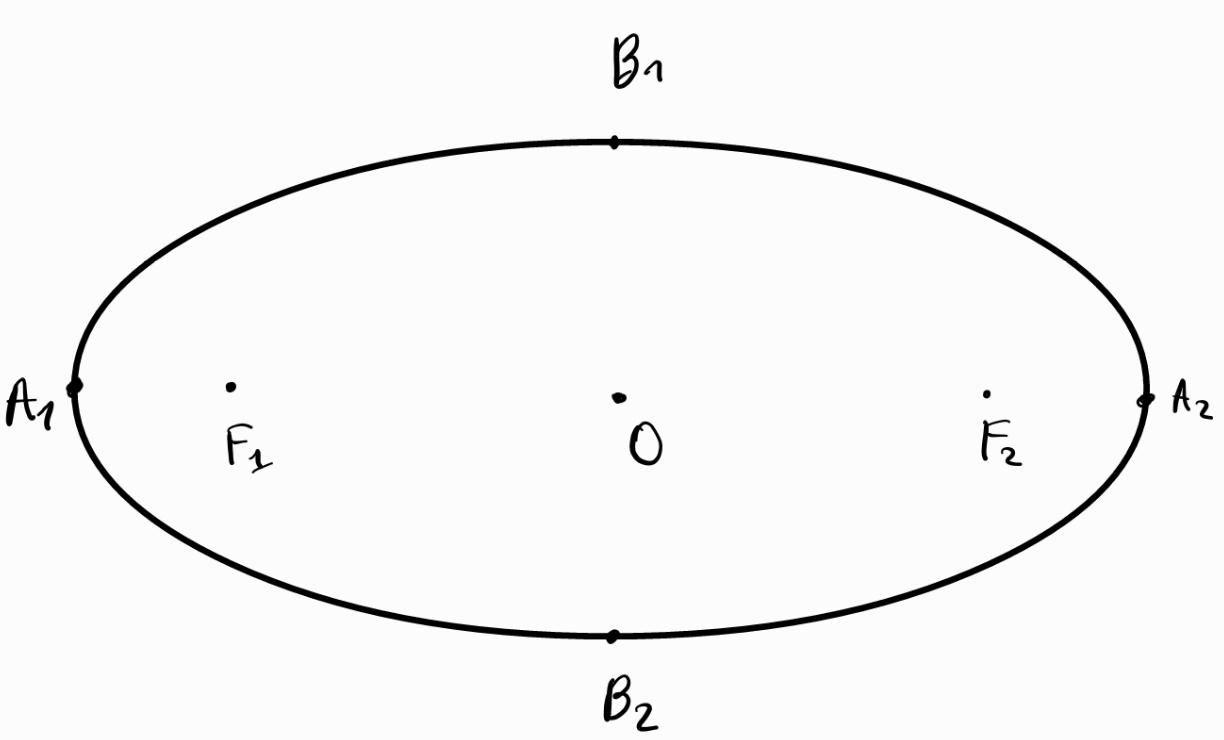
а) фокуси на елипсата - точките
б) център на елипсата - средата на отсечката
в) ос на елипсата - всяка отсечка, която свързва две точки от елипсата
- голяма ос () - най-дългата ос в елипсата, която свързва двете най-отдалечени една от друга точки ( и )
- малка ос () - най-късата ос в елипсата, която вързва двете най-близки една до друга точки ( и )
Центърът и двата фокуса на елипсата винаги лежат на нейната голяма ос.
Голямата и малката оси на елипсата са взаимноперпендикулярни и се разполовяват в нейния център.
-
Канонично уравнение на елипса с център началото на кординатната система
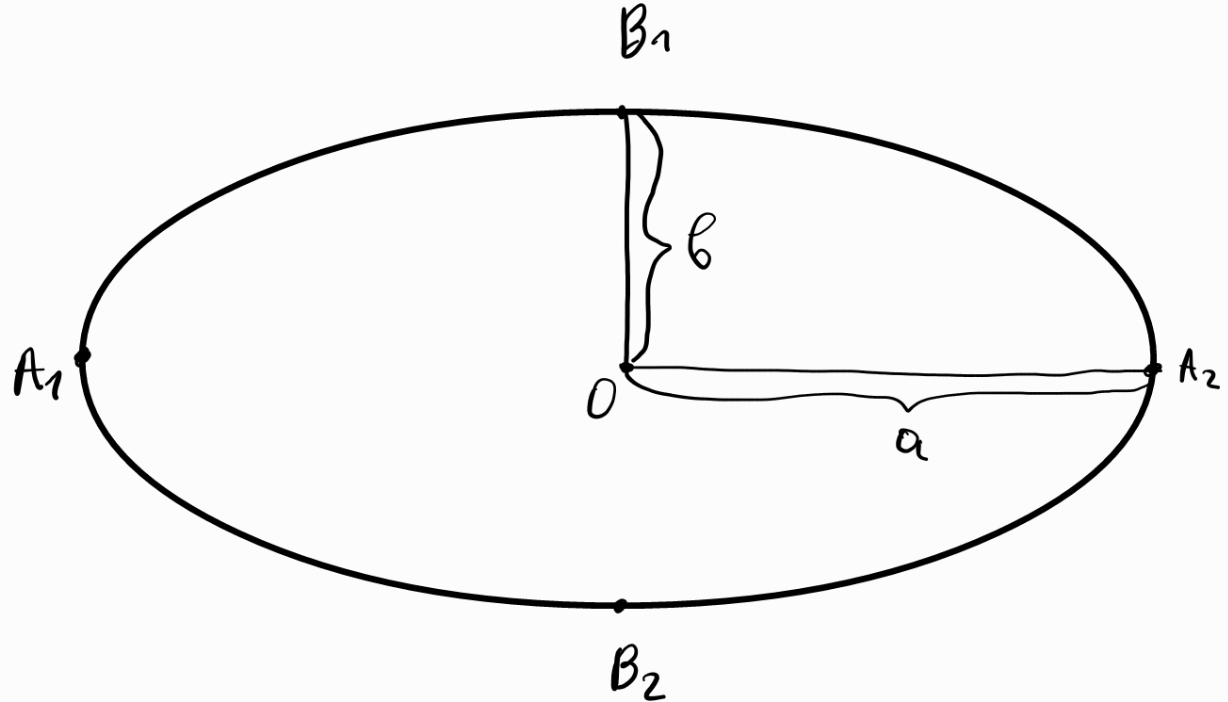
а) координати на фокусите:
б) взаимно положение с права
- нямат пресечни точки:
- допират се в една точка:
- пресичат се в две точки:
в) допирателна към елипса
- през точка
-
Окръжност () - всички точки в една равнина, които са на определено разстояние от дадена точка
а) радиус - отсечка с краища точка и произволна точка от самата окръжност
б) хорда - отсечка с краища две точки от окръжността
- дъга - една от двете части, на които дадена хорда разделя окръжността
Две дъги от една окръжност са равни тогава и само тогава, когато съответните им хорди са равни.
Две хорди в една окръжност са равни тогава и само тогава, когато са на равни разстояния от центъря на окръжността.
Дъгите от една окръжност, заградени между две успоредни хорди, са равни.
в) диаметър - хорда, минаваща през центъра на окръжността
Диаметър на окръжността е перпендикулярен на недиаметрална хорда тогава и само тогава, когато я разполовява.
-
Вписан ъгъл - ъгъл, чийто връх е точка от окръжността, а рамената му пресичат окръжността
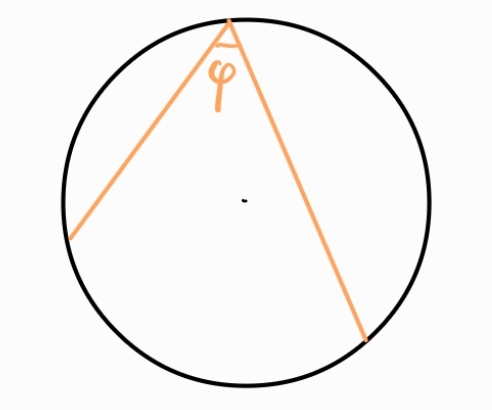
Всеки вписан ъгъл е половината от съответния си централен ъгъл.
Вписан ъгъл, чиито рамена минават през краищата на диаметър, е прав.
-
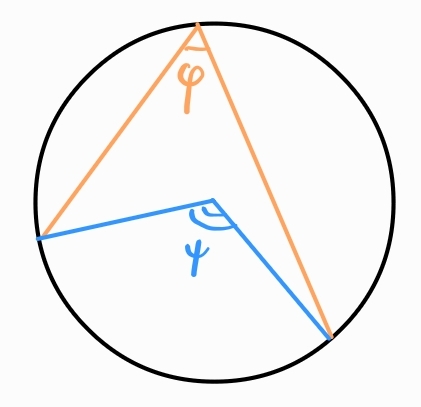
Периферен ъгъл - ъгъл, чийто връх е точка от окръжността, едното му рамо е допирателна, а другото я пресича
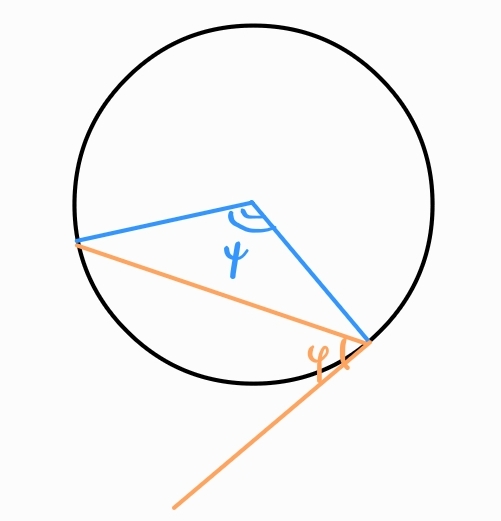
Всеки периферен ъгъл е половината от съответния си централен ъгъл.
Аналитична геометрия на окръжност
-
Канонично уравнение на окръжност
а) център: точката
б) радиус:
-
Обобщен вид на уравнението на окръжност
а) решения - не всяко уравнение от този вид отговаря на окръжност
- няма решения - нито една точка от равнината
- едно решение - окръжността е сведена до единствена точка
- безброй решения - уравнението отговаря на единствена окръжност
б) преобразуване в каноничен вид - възможно само ако уравнението има безброй решения
-
Допирателна към окръжност през точка от окръжността
-
Допирателна към окръжност през точка , която е извън окръжността
Доказателство
-
Парабола - геометрично място от точки, за които разстоянието до предварително определена точка е равно на разстоянието до предварително определена права
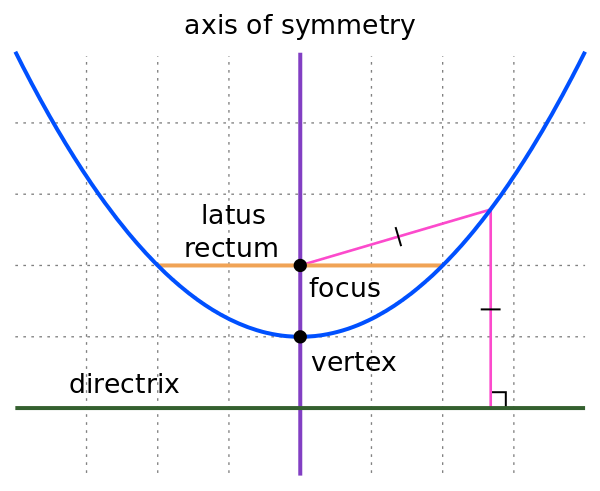
а) фокус на параболата - точката
б) директриса на параболата - правата
- директрисата винаги е успоредна на допирателната през върха на чараболата
в) връх на параболата - точката
- най-близката до директрисата и фокуса точка
г) ос на симетрия - правата
-
Уравнение на парабола с фокус и директриса
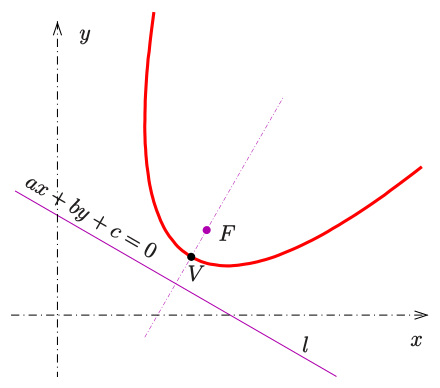
-
Канонично уравнение на парабола -
а) фокус на параболата:
б) директриса на параболата:
в) взаимно положение с правата
- нямат пресечни точки:
- допират се в единствена точка:
- пресичат се в две точки:
г) допирателна към параболата
- през точка
-
Хипербола - геометрично място от точки в равнината, за които абсолютната стойност на разликата от разстоянията до две предварително определени точки е постоянна
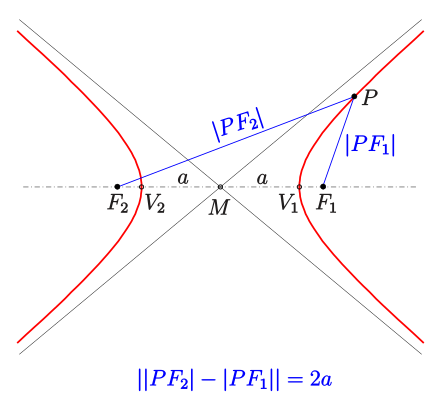
а) фокуси на хиперболата - точките и
б) център на хиперболата - точката , която е среда на
в) върхове на хиперболата - точките и
-
Канонично уравнение на хипербола с център началото на кординатната система
а) координати на фокусите:
б) координати на върховете:
в) взаимно положение на хипербола и права
- пресичат се в две точки:
- допират се в една точка:
- няма пресечни точки:
г) допирателна към хиперболата
- през точка
- през точка
-
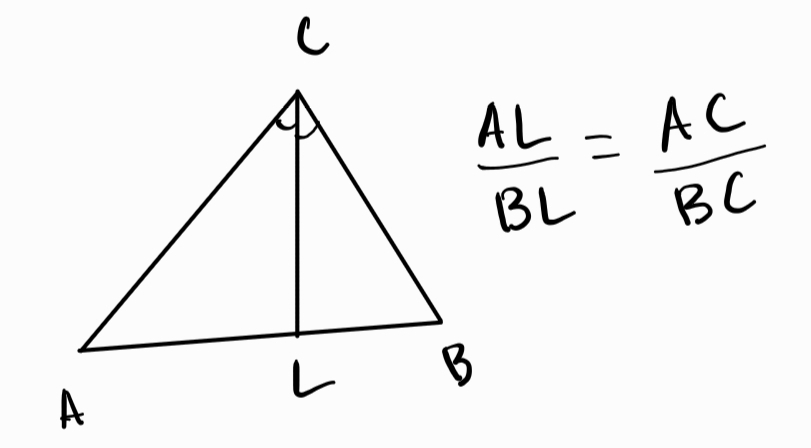
Вътрешна ъглополовяща - права, която разделя ъгъл на триъгълника на два равни ъгъла
а) свойства
- трите ъглополовящи в триъгълника се пресичат в центъра на вписаната в триъгълника окръжност
- всяка точка от ъглополовящата се намира на равни разстояния от раменете на ъгъла
- ъглополовящата разделя срещуположната страна на две отсечки, чието отношение е равно на отношението на прилежащите към тях страни на триъгълника
б) дължина - корен от произведението на прилежащите страни минус произведението на парчетата, на които разделя срещуположната страна
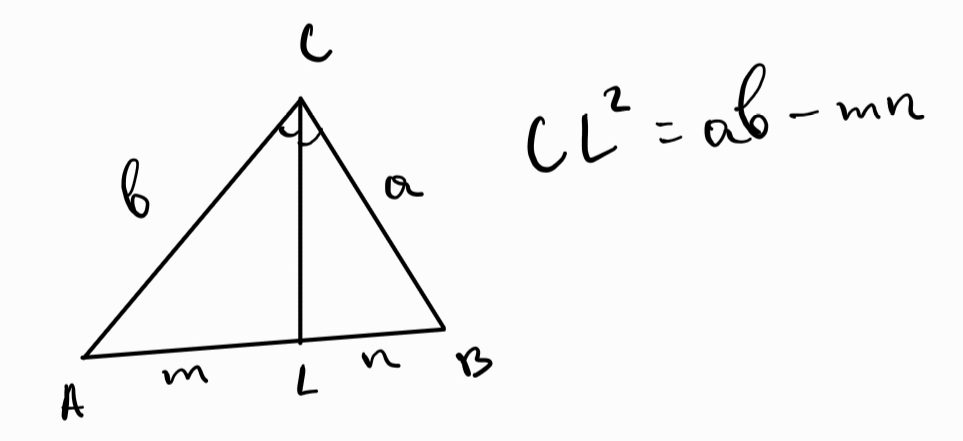
-
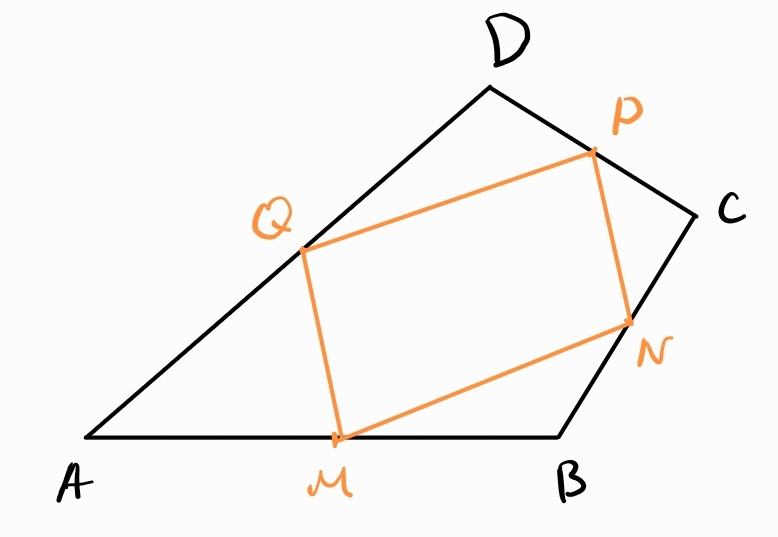
Теорема на Варинион - ако е произволен четириъгълник и точките са среди на страните му, то четириъгълникът е успоредник
а) следствие - лицето на четириъгълника е два пъти лицето на Варинионовия му успоредник
-
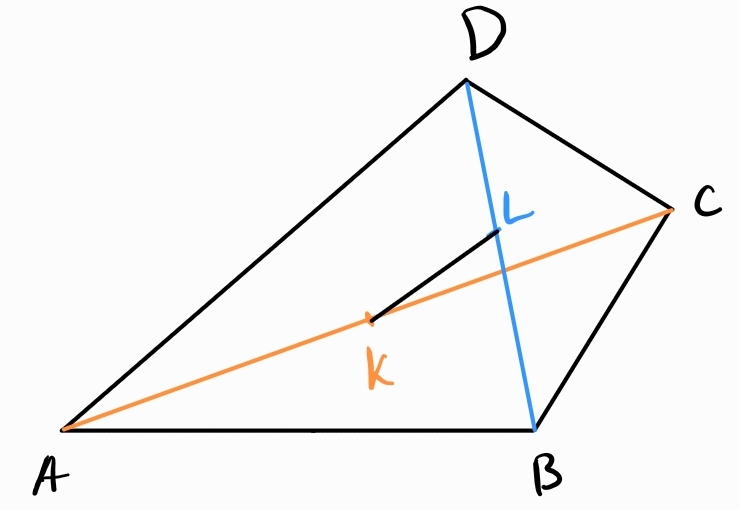
Теорема на Ойлер - ако е произволен четириъгълник и точките са среди на диагоналите му, то е вярно, че
-
Вписан четириъгълник - четириъгълник, около който може да се опише окръжност
Четириъгълник е вписан тогава и само тогава, когато сборът на два от срещуположните му ъгли е 180°.
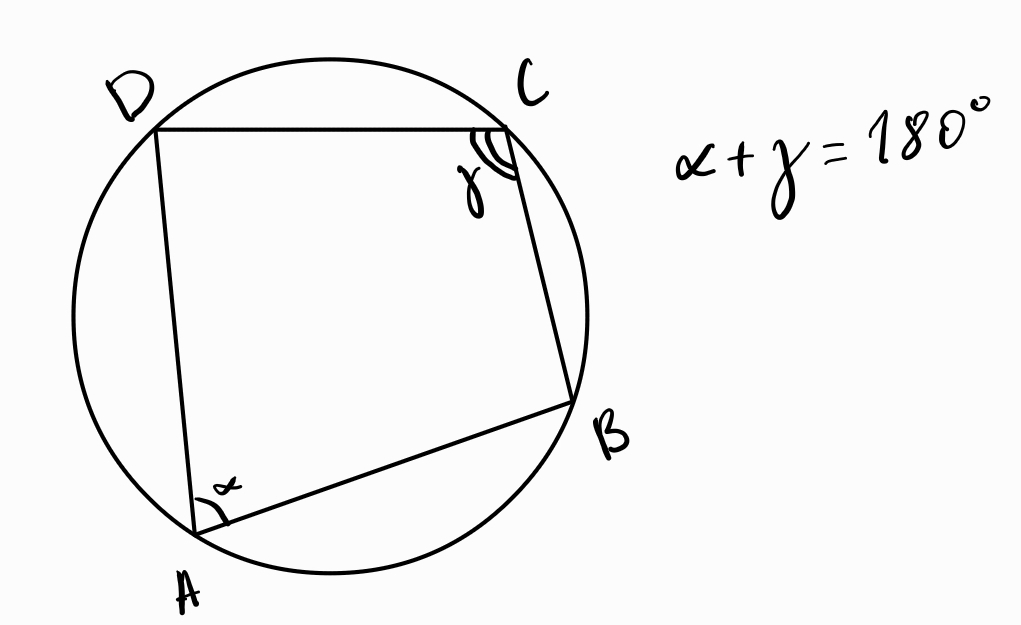
Четириъгълник е вписан тогава и само тогава, когато някоя от страните му се вижда под един и същ ъгъл от другите два върха на четириъгълника.
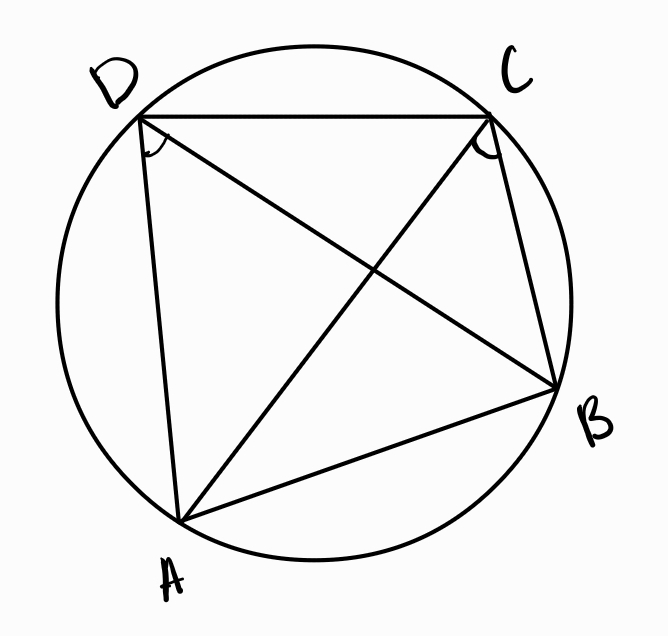
а) теорема на Птолемей - произведението на диагоналите във вписан четириъгълник е равно на сбора от произведенията на срещуположните му страни
б) лице - теорема на Брахмагупта
-
Описан четириъгълник - четириъгълник, в който може да се опише окръжност, която се допира до четирите му страни
Четириъгълник е описан тогава и само тогава, когато три от ъглополовящите му се пресичат в една точка.
Четириъгълник е описан тогава и само тогава, когато сборът на две негови срещуположни страни е равен на сбора на другите му две страни.
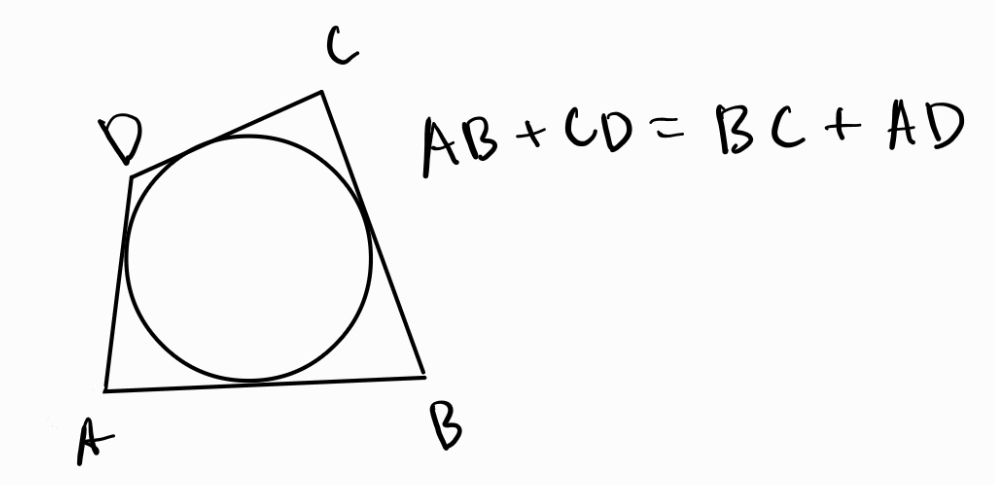
а) лице на описан четириъгълник
- радиус на вписаната окръжност:
- полупериметър на четириъгълника:
-
Ограден четириъгълник - четириъгълник, който е и вписан, и описан
а) лице
-
Трапец - четириъгълник, на който поне една двойка срещуположни страни са успоредни
а) средна основа - успоредна на основите на трапеца
б) лице
-
Равнобедрен трапец - трапец с равни бедра
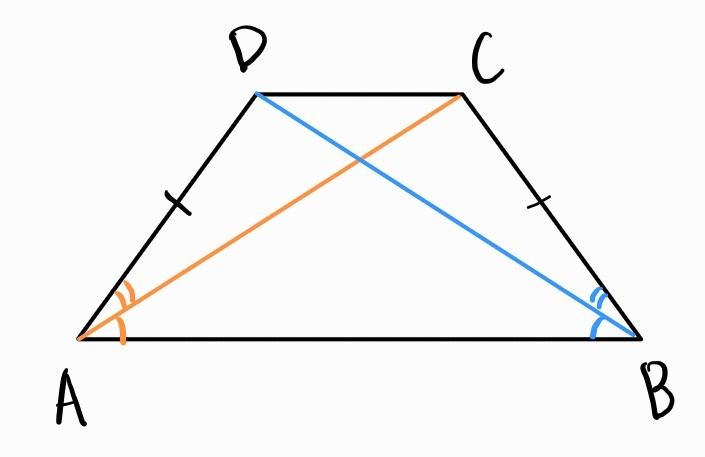
а) ъгли
- равни ъгли при основите
Трапец е равнобедрен тогава и само тогава, когато има равни ъгли при основите.
б) диагонали
- равни помежду си
- сключват равни ъгли с основите на трапеца
Трапец е равнобедрен тогава и само тогава, когато има равни диагонали.
Трапец е равнобедрен тогава и само тогава, когато диагоналите му сключват равни ъгли с основите.
в) вписаност - трапец е вписан в окръжност тогава и само тогава, когато е равнобедрен
-
Успоредник - четириъгълник, на който две по две срещуположните страни са успоредни и равни помежду си
а) периметър
б) лице
в) диагонали
- взаимно се разполовяват
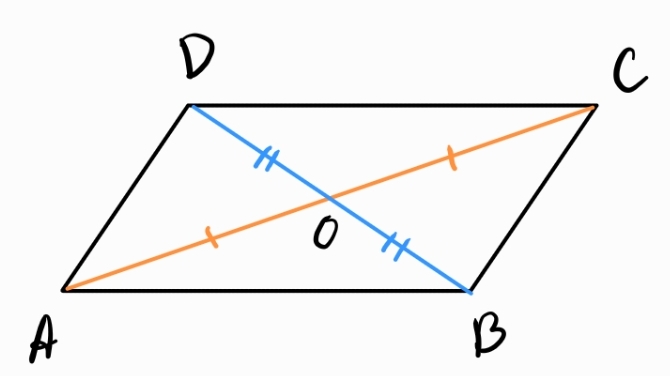
Всеки четириъгълник с взаимноразполовяващи се диагонали е успоредник.
- следствие от теоремата на Ойлер:
-
Вписан успоредник - около успоредник може да се опише окръжност тогава и само тогава, когато е правоъгълник
-
Описан успоредник - в успоредник може да се впише окръжност тогава и само тогава, когато е ромб
-
Ромб - успоредник с четири равни страни
Всеки четириъгълник с четири равни страни е ромб.
а) диагонали
- ъглополовящи на ъглите на ромба
- взаимноперпендикулярни
Всеки успоредник с взаимноперпендикулярни диагонали е ромб.
б) лице
в) описаност - във всеки ромб може да се впише окръжност
-
Насочена отсечка - отсечка с определено начало и край
а) равенство - две насочени отсечки са равни, когато имат еднаква дължина и посока
б) взаимно положение
- колинеарност - насочени отсечки са колинеарни, когато лежат на една права или на успоредни прави
- компланарност - насочени отсечки са компланарни, когато лежат в една равнина
Всяка двойка насочени отсечки са компланарни спрямо една друга.
- еднопосочност - две насочени отсечки са еднопосочни, когато сочат в една и съща посока (сириозно???)
- противопосочност - две насочени отсечки са противопосочни, когато сочат в две противополжни посоки (наистина ли така си мислити?)
- разнопосочност - всичко останало
-
Вектор - множеството от всички равни помежду си насочени отсечки
а) събиране - началото на единия се слага до края на другия
б) изваждане - към първия се добавя противоположното на другия
в) произведение със скалар ()
- когато - дължината на вектора се променя пъти, а посоката му се запазва същата
- когато - векторът се превръща в нулевия вектор
- когато - дължината на вектора се променя пъти, а посоката му се обръща на 180 градуса
г) взаимно положение
- колинеарност - вектори са колинеарни, когато представителите им лежат на успоредни прави
- компланарност - вектори са компланарни, когато представителите им лежат в една равнина
Всяка двойка вектори са компланарни.
- линейна зависимост - множество от вектори са линейно зависими, когато всеки един може да се представи като линейна комбинация от останалите
Два вектора са линейно зависими тогава и само тогава, когато съществувават числа такива, че
- линейна независимост - множество от вектори са линейно зависими, когато нито един от тях не може да се представи като линейна комбинация от останалите
Два вектора са линейно независими тогава и само тогава, когато единственото решение на равенството е .
-
Векторна база - множество от линейно независими вектора, чрез които може да се изрази всеки друг вектор в -измерното пространство
а) върху права - всеки ненулев вектор сам по себе си образува векторна база в едно измерение
б) в равнината - всеки два неколинеарни (и ненулеви) вектора образуват векторна база в две измерения
г) в пространството - всеки три некомпланарни вектора образуват векторна база в три измерения
-
Скаларно произведение
а) свойства
- два вектора са еднопосочни тогава и само тогава, когато
- два вектора са противопосочни тогава и само тогава, когато
- два вектора са перпендикулярни тогава и само тогава, когато
б) тъждество на Ойлер - за всеки четири произволни точки е изпълнено, че
В равнината
-
Уравнение на права
а) общо уравнение
- нормален вектор () - единичен вектор, перпендикулярен на правата
- всяка права има два единични вектора, които са противопосочни един на друг
\vec{n} = \begin{bmatrix} \pm \frac{a}{\sqrt{a^2 + b^2}} \ \pm \frac{b}{\sqrt{a^2+b^2}} \end{bmatrix}
б) Декартово уравнение
- наклон на правата () - тангенсът на ъгъла между правата и положителния лъч на абсцисната ос
- височина на правата () - ординатата на пресечната точка с ординатната ос
- връзка с общото уравнение
в) през две точки - и
-
Взаимно положение на две прави
а) с общи уравнения
б) с Декартови уравнения
-
Разстояние от точка до права
-
Ъгъл между две прави - по-малкият ъгъл
а) с общи уравнения
б) с Декартови уравнения
-
Правилен -ъгълник - многоъгълник, чиито всички ъгли и страни са равни
а) ъгли - означават се с
- всеки ъгъл в правилен -ъгълник има следната стойност
- сумата от ъглите в правилен -ъгълник е
б) ограденост
- във всеки правилен многоъгълник може да се впише единствена окръжност с радиус
- около всеки правилен многоъгълник може да се опише единствена окръжност а радиус
- връзка между двата радиуса
- вписаната и описаната окръжност са концентрични
- център на многоъгълника - общият за двете окръжност център
в) страни - означават се с
- връзка с радиуса на вписаната окръжност
- връзка с радиуса на описаната окръжност
в) лице
- чрез страната
- чрез радиуса на вписаната окръжност
- чрез радиуса на описаната окръжност
-
Пропорционални отсечки - отсечките и са пропорционални съответно на отсечките и , ако
а) коефициент на пропорционалност
б) среднопропорционална отсечка - отсечката се нарича среднопропорционална на отсечките и , ако трите отсечки образуват пропорциата
в) свойства на пропорциите
-
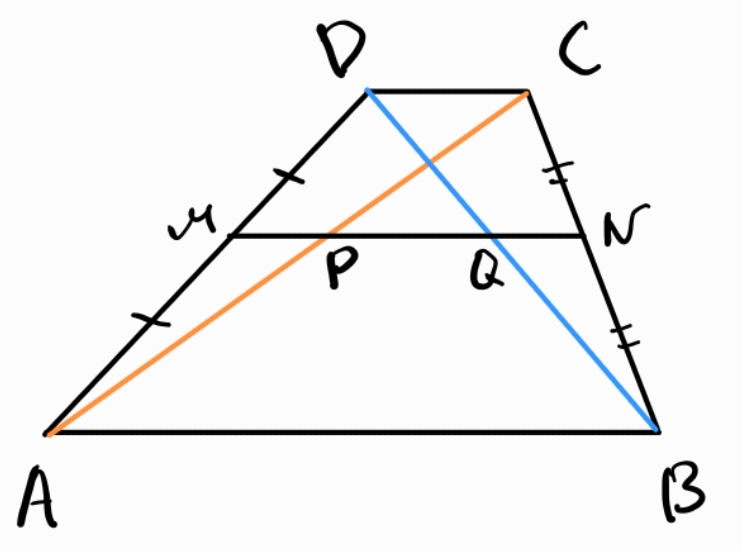
Теорема на Талес - успоредни прави отсичат от две дадени прави пропорционални отсечки
-
Центроид - за всяка система от точки съществува единствена точка , наречена центроид, такава, че
а) локализиране на центроида - за всяка произволна точка е изпълнено следното равенство
б) центроид на две системи - ако и са системи от точки с центроиди съответно точките и , то центроидът на комбинираната система лежи на правата е изпълнено, че
За и е вярно, че:
Доказателство:
За имаме , което е вярно като равенство.
Нека приемем, че за е вярно, че
Тогава за се опитваме да докажем, че
имаме, че
За и положителни числа е вярно, че:
-
Радиан - мярката на централния ъгъл , на който съответства дъга с дължина, равна на радиуса на окръжността
а) конвертиране
- от градуси в радиани
- от радиани в градуси
б) основни ъгли
-
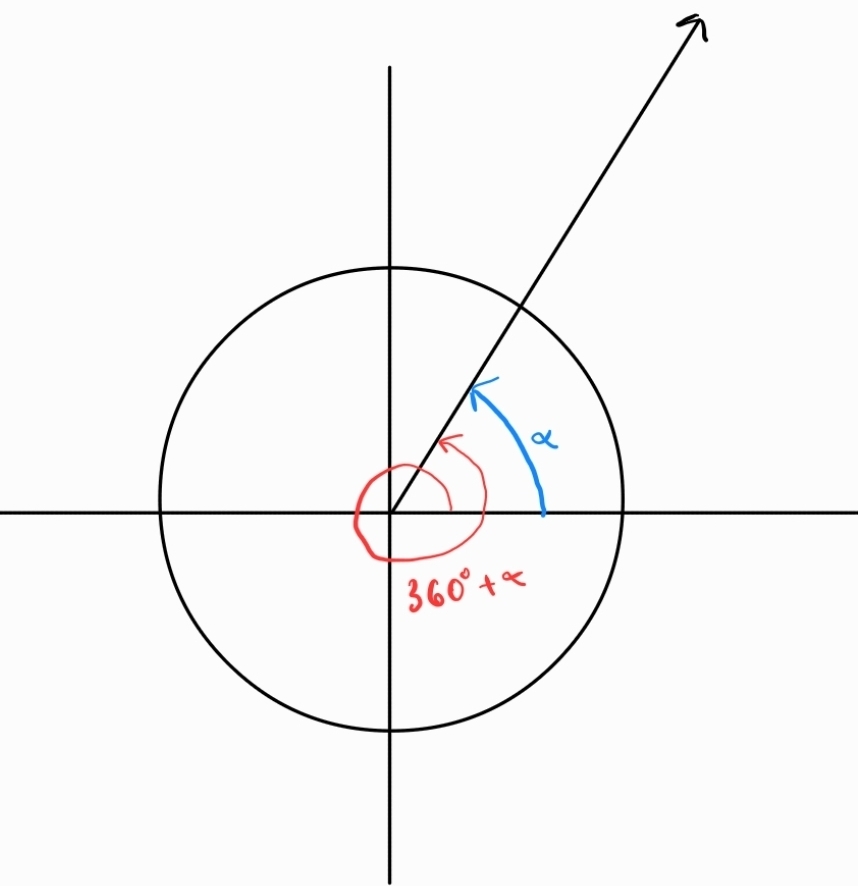
Обобщен ъгъл - ъгъл с мярка , където е мярката на ъгъла между абсцисната ос и другото рамо, а представлява брой пълни завъртания около центъра на координатната система
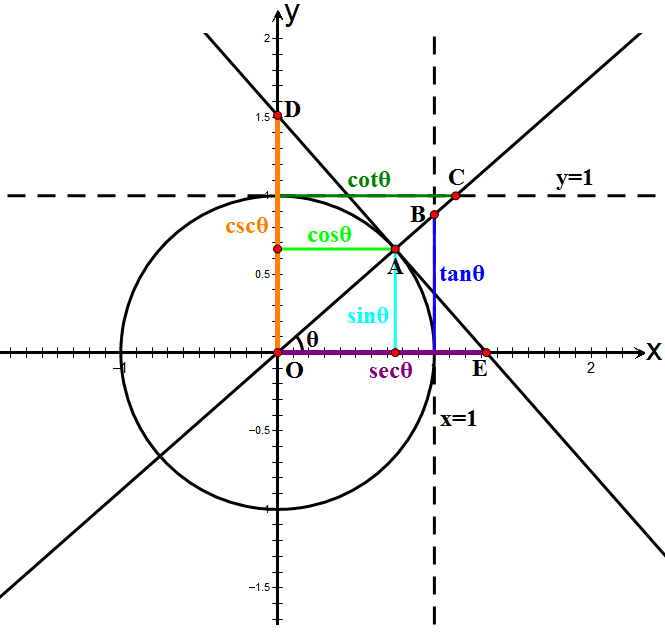
-
Синус на обобщен ъгъл - функцията на обобщения ъгъл е ординатата на пресечната точка на второто рамо на ъгъла с единичната окръжност
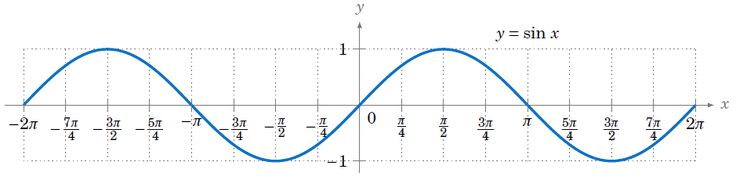
а) свойства
- период:
- нечетност
-
Косинус на обобщен ъгъл - функцията на обобщения ъгъл е абсцисата на пресечната точка на второто рамо на ъгъла с единичната окръжност
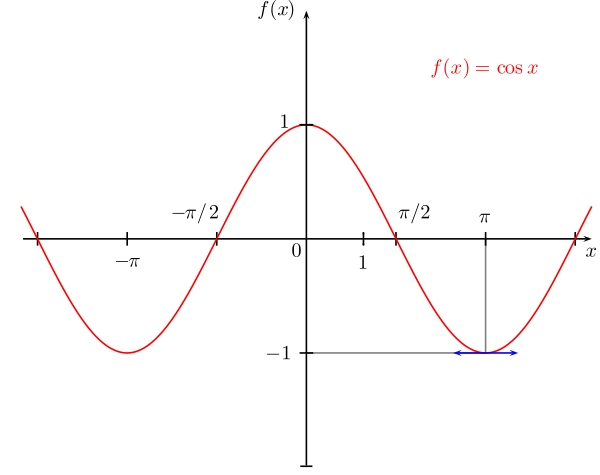
а) свойства
- период:
- четност
-
Тангенс на обобщен ъгъл - функцията на обобщения ъгъл е ординатата на пресечната точка на второто рамо на ъгъла с единичната окръжност
а) свойства
- период:
- нечетност
-
Котангенс на обобщен ъгъл - функцията на обобщения ъгъл е абсцисата на пресечната точка на второто рамо на ъгъла с единичната окръжност
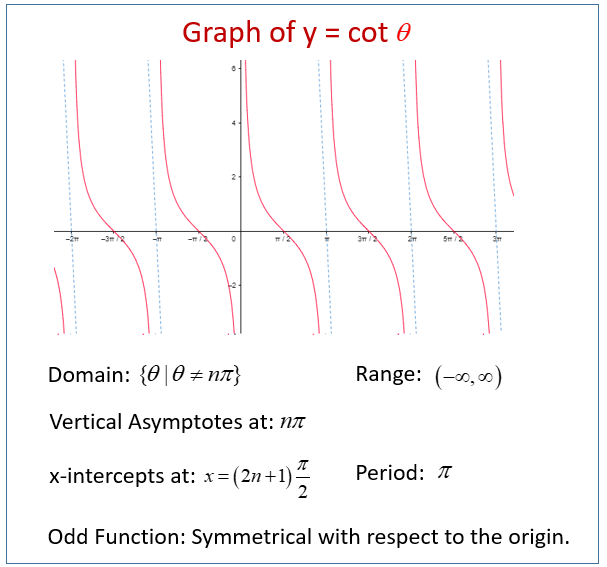
а) свойства
- период:
- нечетност
Формули за сбор и разлика на ъгъл
Формули за удвоения ъгъл
Формули за половината на ъгъл
Формули за понижаване на степента
Формули за универсална субституция
Формули за произведение
Формули за сбор на тригонометрични функции
-
Логаритъм - единственото решение на уравнението при
а) означение
- чете се "логаритъм от при основа "
-
Основни свойства
a) сравняване
- при :
- при :
- определяне на знака
-
Преобразуване на логаритми
а) логаритъм на произведение - става сбор от логаритмите на множителите
б) логаритъм на частно - става разлика от логаритмите на числителя и знаменателя
в) логаритъм от степен - степента излиза пред логаритъма
г) смяна на основата - когато искаме да превърнем логаритъм с една основа в логаритъм с друга основа по наш избор
- разменяне на аргумента и основата
- изваждане на степен от основата - реципрочното на степента отива пред логаритъма
- изваждане на степен от аргумента и основата
-
Графика
а) за - растяща функция
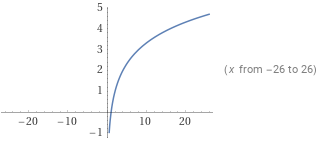
б) за - намаляваща функция
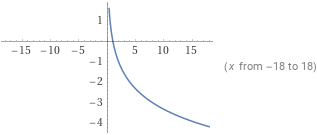
-
Точност на измерването - уредите, с които се измерват физични величини, не са перфектни и са неспособни да дадат напълно точно реалната стойност на измерваната величина: те винаги дават приблизителна стойност
а) видове неточности по причина на възникване
- инструментални грешки - самият измервателен уред има лимит на своята точност
- методични грешки - самият метод на измерване е несъвършен
- груби грешки - възникват при повреда в уреда или поради невнимание на експериментатора
б) видове неточности по характер на проявяване
- случайни грешки - различни по големина и знак при различните измервания и невъзможни за възпроизвеждане
- систематични грешки - променящи (или непроменящи) се грешки, които следват някакъв закон във времето и могат да се предскажат и поправят
в) статистически методи за повишаване на точността - за да се получи по-достоверна представа за реалната стойност на дадена величина (да се намали ефекта на случайните грешки), се правят множество измервания и като стойност на величината се взима тяхното средноаритметично
- колкото повече измервания се направят, толкова повече средното им аритметично се доближава до реалната стойност на величината
-
Грешка на измерването - характеризира отклонението на дадено измерване от средната стойност
а) абсолютна грешка () - записва се като добълнителна стойност след стойността на измерването чрез знака
- по конвенция е добре да бъде с максимум 2 значещи цифри
- измерва се в същата мерна единица като величината, към която принадлежи
Пример: - реалната стойност на масата се намира между и .
б) относителна грешка () - отношението на абсолютната грешка към стойността на самото измерване
- измерва се в проценти
-
Грешка на средното аритметично - самото средноаритметично, макар и по-точно от отделните измервания, също е приблизителна величина и има своята грешка, която зависи от грешките на отделните измервания
а) абсолютна грешка - модификация на средноквадратичното на грешките на отделните измерванията
б) относителна грешка () - съотношението на абсолютната грешката към средното аритметично
-
Операции с неточни величини - когато се извършват математически действия с неточни величини, резултатът също е неточна величина, чиято грешка зависи от грешките на операндите
Действие Абсолютна грешка Относителна грешка -
Значещи цифри - конвенция за записване на неточни величини и техните грешки, при която, ако липсва записана грешка, тя се смята за имплицитно натрупана в последната значеща цифра
а) определяне на значещите цифри - цифрите в мантисата на резултата, записан в научен запис
- ако стойността не е в научен запис и няма цифри след десетичната запетая, записът е нееднозначен и не е възможно определянето на значещите цифри
- ако стойността не е в научен запис, но има цифри след десетичната запетая, за значещи цифри се броят всички цифри освен нулите между запетаята и първата ненулева цифра (нулите след първата ненулева цифра са значещи)
а) умножение и деление - резултатът се записва с толкова значещи цифри, колкото има най-неточният операнд
б) събиране и изваждане - резултатът има толкова цифри след десетичната запетая, колкото има операндът с най-малко цифри след запетаята
-
Кинематика - дял от механиката, занимаваш се с движението, без да се интересува от причините за него
-
Отправна система - движението винаги се разглежда спрямо определено тяло, което се приема за неподвижно
а) отправно тяло - тялото, което приемаме за неподвижно
б) координатна система - има за начало отправното тяло
в) часовник - отмерва времето
-
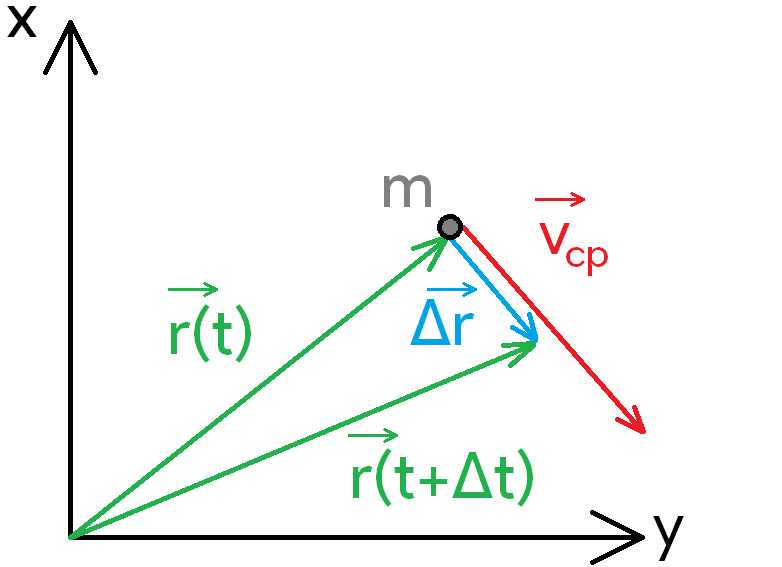
Радиус-вектор () - вектор, който сочи от началото на отправната система до местоположението на тялото
а) път - дължината на траекторията, която тялото изминава докато се движи
б) преместване () - разликата в радиус-вектора на новото местоположение и радиус-вектора на старото
-
Скорост ()
а) средна скорост - преместването на тялото за определен период от време
б) моментна скорост - преместването на тялото за безкрайно малък интервал от време
-
Ускорение
а) средно ускорение - промяната в скоростта за определен период от време
б) моментно ускорение - промяната в скоростта за безкрайно малък интервал от време
-
Покой - скоростта и ускорението са нула и тялото не се движи
-
Равномерно движение - скоростта е константна и ненулева, а ускорението е нула
а) закон за движението
-
Равнопроменливо движение - ускорението е константно
а) закон за скоростта
б) закон за движението
-
Криволинейни движение - движение по дадена крива
а) моментна скорост - като производна на местоположението моментната скорост винаги е перпендикулярна на кривата
б) ускорение
-
Тяло, хвърлено под ъгъл - върху такова тяло действа само земното ускорение
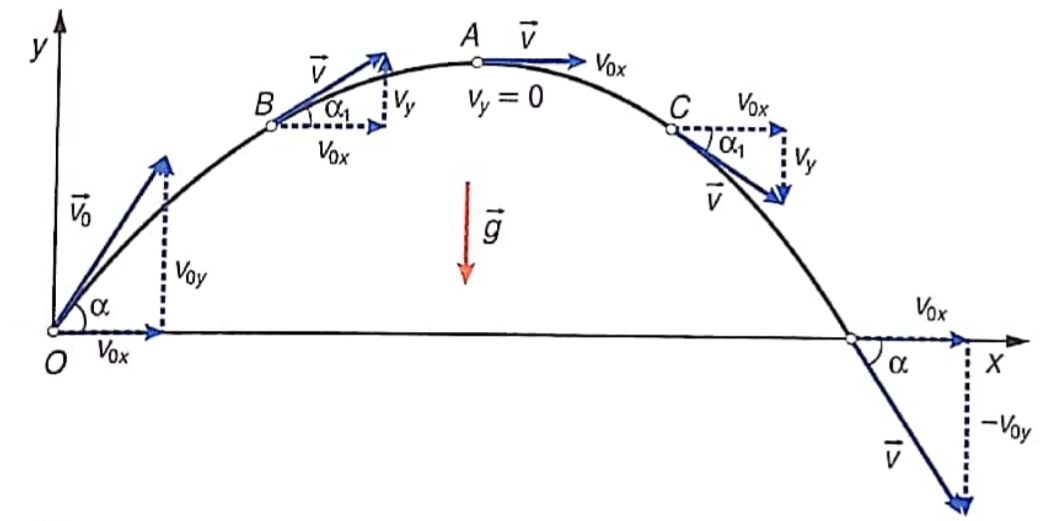
а) независимост на движението - движението на тялото може да се разпадне на движението му по оста и движението му по оста , защото едното не влияе на другото
- следва от факта, че векторното равенство
може да се разпадне на равенства между компонентите
б) равномерно движение по оста - земното ускорение действа само по оста , следователно тялото се движи равномерно (без ускорение) по оста
б) равнопроменливо движение по оста - движението по оста е равнопромелниво, защото по тази ос на тялото действа константното земно ускороние с големина
-
Уравнение на траекторията - движението по оста може да се изрази чрез движението по оста като се комбинират законите за движението по двете оси и се замести
а) изминато разстояние
- оптимален ъгъл за хвърляне на най-далечно разстояние:
Доказателство: Изминатото разстояние е -координатата, когато тялото отново се намира на . Намираме момента, в което това става:
Заместваме в уравнението за :
Този израз има максимална стойност при , което означава, че за максимално изминато разстояние, ъгълът трябва да е 45°.
б) максимална височина - при максималната височина тялото има нулева , защото обръща посоката си - вече започва да пада надолу
-
Радиан - естествена и безразмерна мярка за ъгъл
а) определение - един радиан е ъгълът, който отговаря на дъга с дължина радиуса на окръжността
б) измерване на централен ъгъл в радиани - ъгълът в радиани е равен на съотношението между дължината на отговарящата му дъга и радиуса
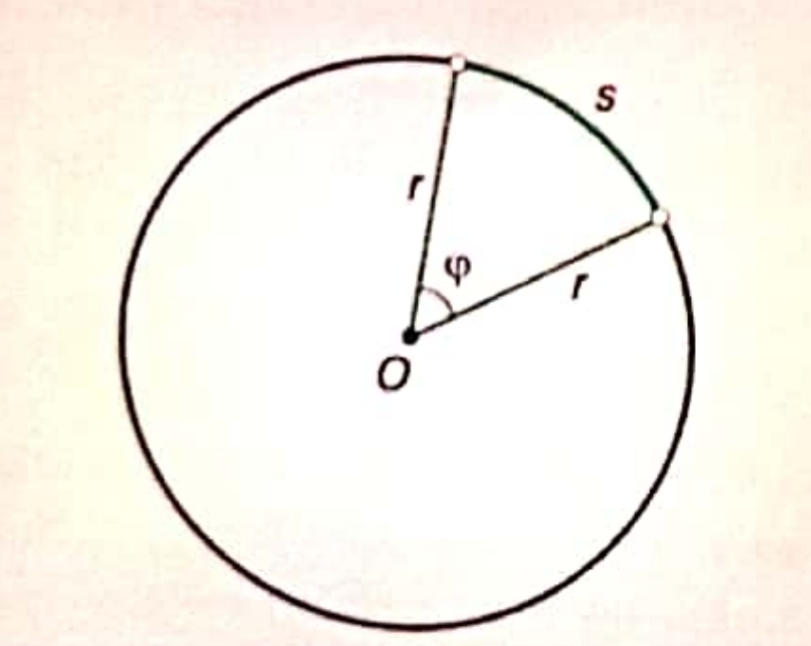
в) зависимост между радиани и градуси - на цялата окръжност от 360° градуса съответстват радиана
-
Движение по окръжност с постоянна скорост - големината на скоростта е константа
а) скорост - винаги перпендикулярна на окръжността
б) центростремително ускорение - ускорението винаги е насочено перпендикулярно на вектора на скоростта и сочи навътре към центъра на окръжността
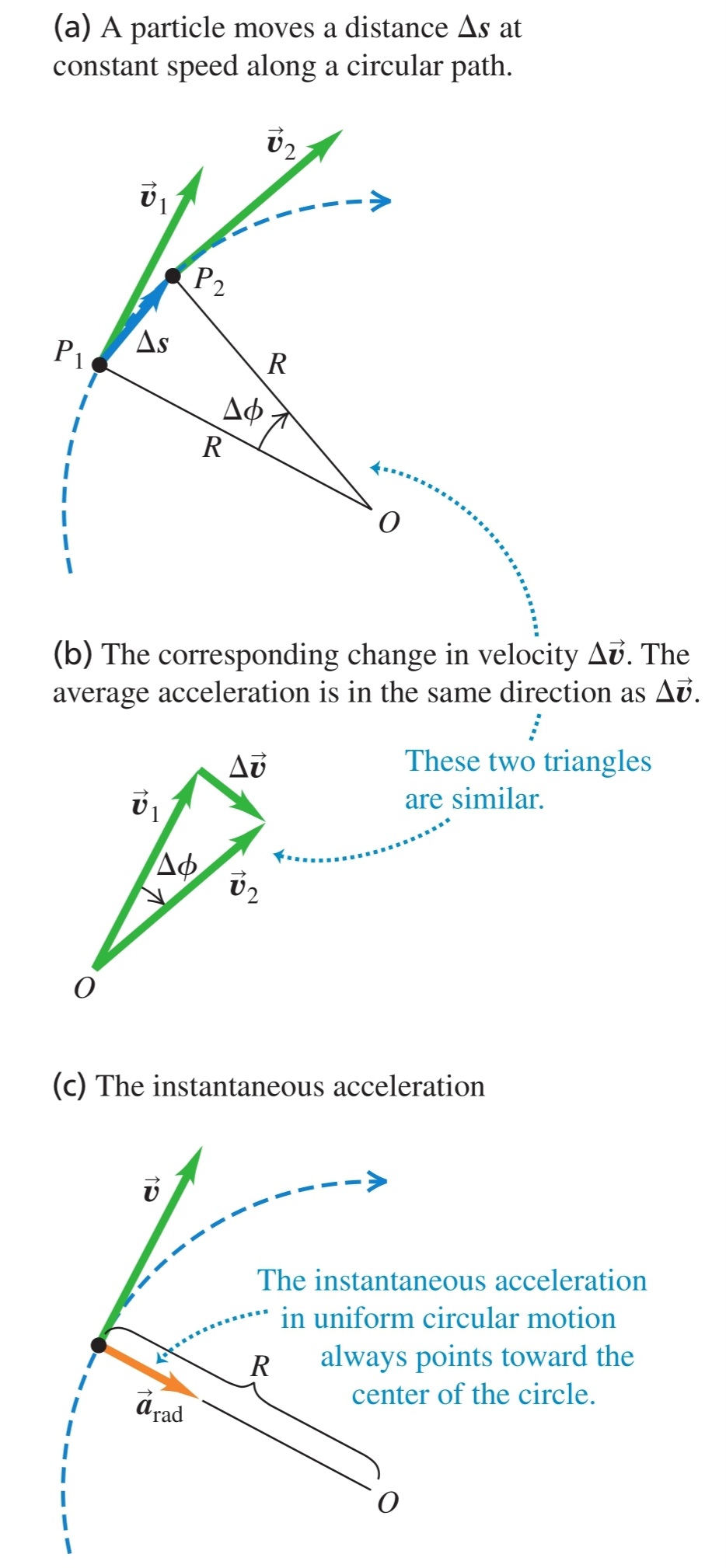
Доказателство:
От и следва, че (след преместване на векторите на скоростта в точката ). Следователно
От лимита на това уравнение се получава, че
$$
-
Скорост - скоростта винаги е перпендикулярна на траекторията
-
Ускорение - ускорението може да се раздели на две компоненти - едната по оста на скоростта и другата перпендикулярно на нея
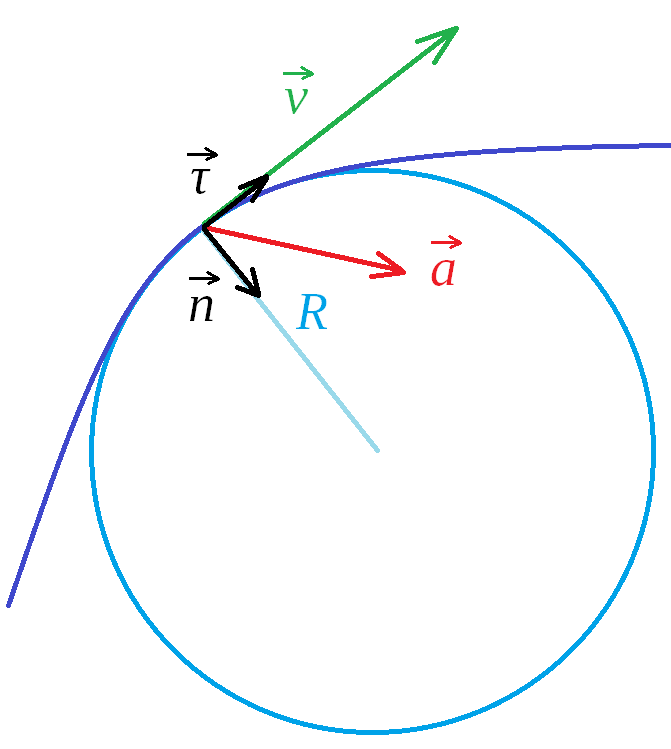
а) тангенциално ускорение () - показва само промяната в големината на скоростта
б) нормално (радиално) ускорение () - отговаря само за промяната е посоката на скоростта
- във всеки един момент кривата около точката, в която се намира тялото, може да се оприличи на окръжност с някакъв радиус , което означава, че за безкрайно малък момент от време движението може да се разглежда като движение по окръжност
-
Ъглова кинематика
За да опишем въртенето на телата, е по-удобно да използваме ъглови величини.
а) ъгъл , на който се намира тялото спрямо абсцисната ос - аналог на координатата при въртеливи движения
- навъртян ъгъл () - разликата между новия и стария ъгъл, на който се намира тялото
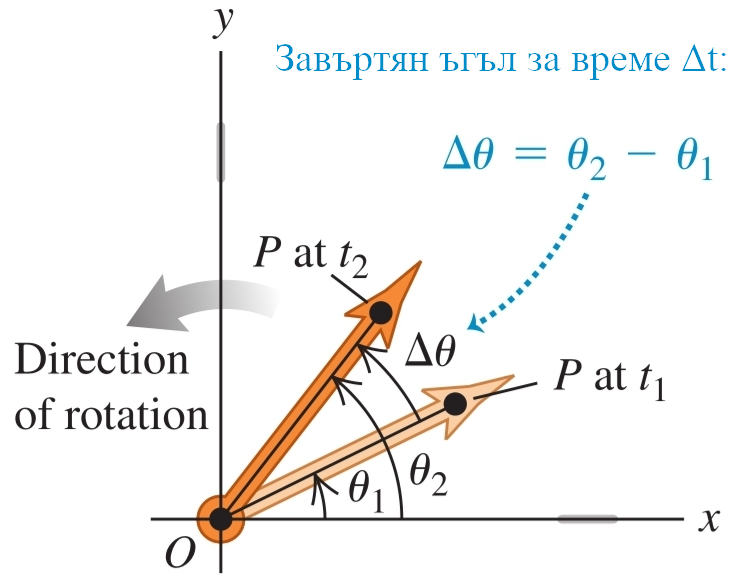
б) ъглова скорост () - псевдовектор (в 3D) с големина - навъртяния ъгъл за единица време
- за въртене в една равнина, има само една ненулева компонента
- посока - определя се от правилото на дясната ръка
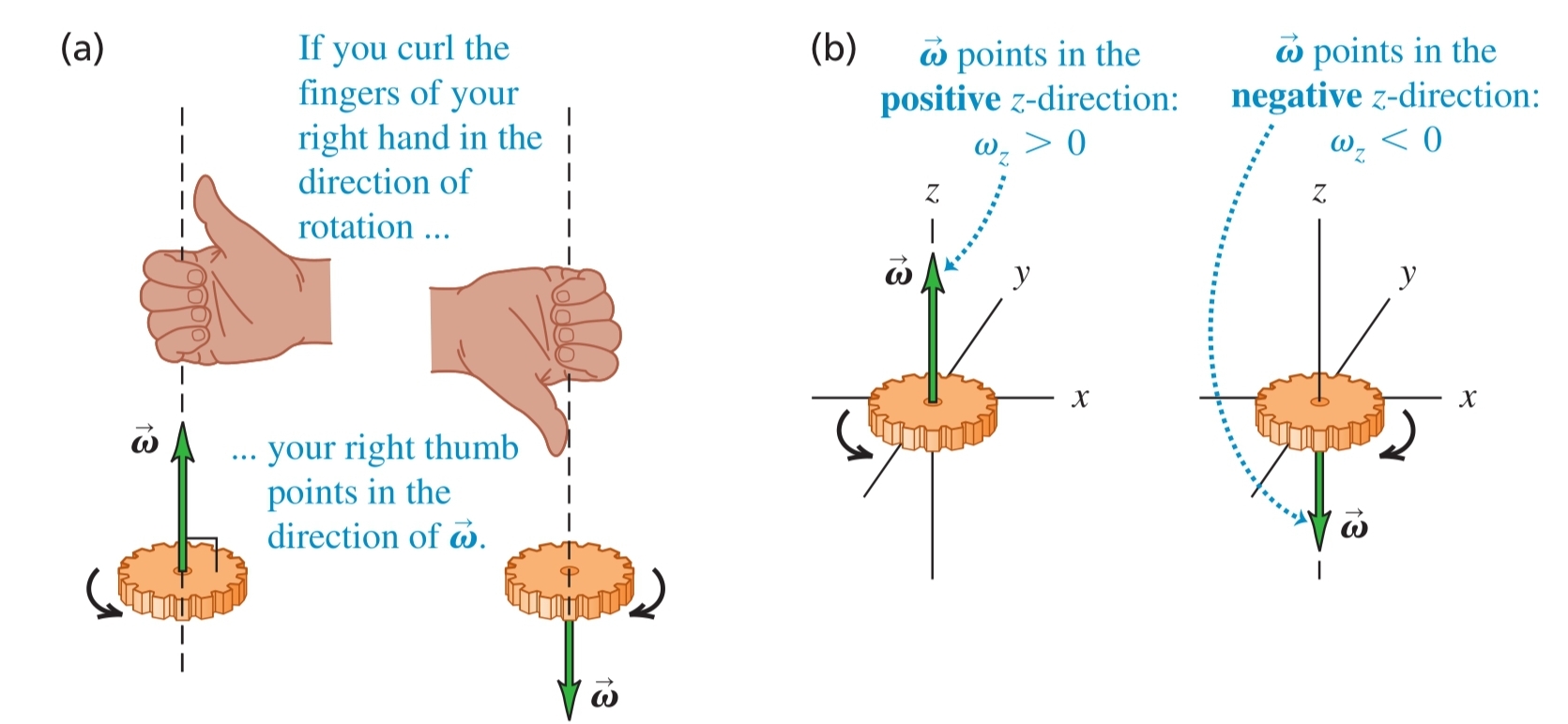
в) ъглово ускорение () - вектор, показващ промяната както в скоростта на въртене, така и в оста на въртене
- когато оста на въртене не се променя, ъгловото ускорение лежи на нея
г) връзки с линейните величини
- линейна скорост:
Доказателство:
- тангенциално ускорение:
Доказателство:
- радиално ускорение:
Доказателство:
-
Сила () - векторна величина, характеризираща взаимодействието между телата
а) мерна единица - нютон
б) принцип на суперпозицията - няколко различни сили, приложени в една и съща точка, имат същия ефект като силата, която представлява тяхната векторна сума
-
Първи принцип на механиката (закон за инерцията) - ако на едно тяло не действат никакви външни сили, то запазва състоянието си на покой или равномерно праволинейно движение
-
Втори принцип на механиката - силата поражда ускорение
-
Трети принцип на механиката - взаимодействията в природата се проявяват винаги като двойки сили с еднакви големини и противоположни посоки, които действат върху две различни тела
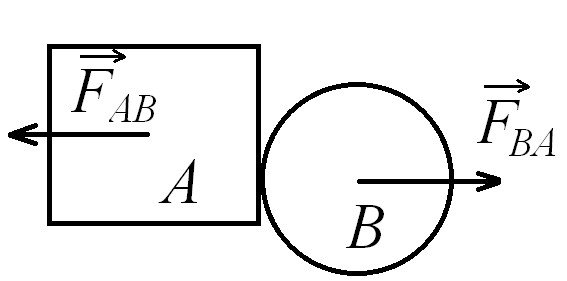
а) сила на реакция на опората - когато едно тяло притиска друго с определена сила, притисканото тяло отговаря със сила на реакция на опората
- винаги насочена перпендикулярно на основата и навън от нея
- има големина равна на компонентата на притискащата сила, която е перпендикулярна на основата
-
Механизъм - когато две повърхности се докосват, между тях се формират и разпадат химични връзки, създавайки сили. Когато се опитаме да придвижим повърхностите една спрямо друга, ефектът на тези сили между повърхностите е обща сила, наречена сила на триене, която се опитва да се противопостави на това движение
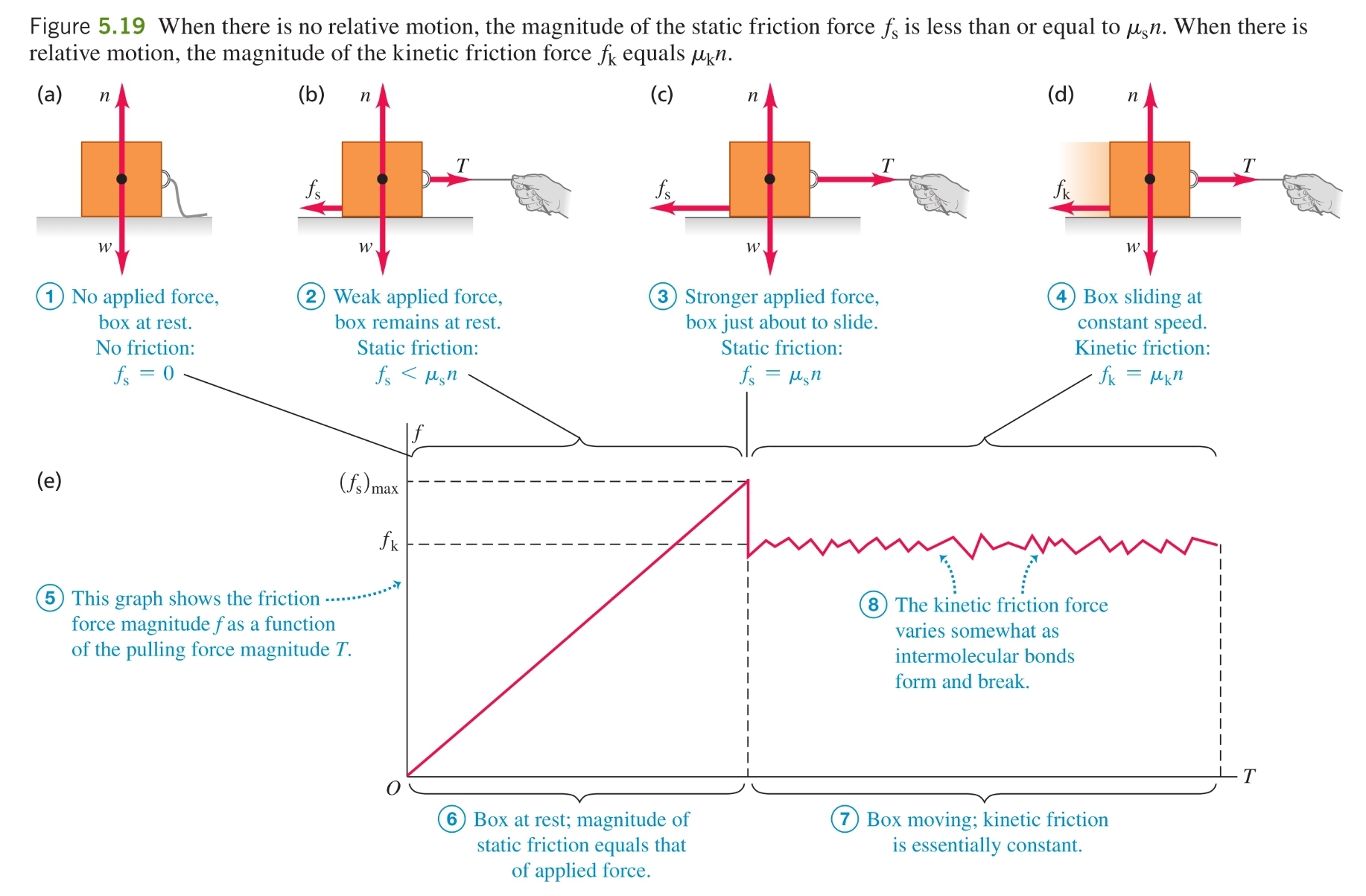
-
Сила на триене при покой () - преди едно тяло да започне да се плъзга по дадена повърхност, върху него трябва да се приложи сила с определена големина. Това е така, защото при прилагането на силата възниква сила на триене при покой , която напълно й противодейства
а) максимална сила на триене - силата на триене при покой има лимит и когато приложената сила го надвиши, тялото започва да се движи
- коефициент на триене при покой: - безразмерен
- сила на реакция на опората:
- когато се надвиши максималната сила на триене при покой, тя спира да действа и започва да действа само силата на триене при хлъзгане
-
Сила на триене при хлъзгане () - силата на триене, когато се надмине максималната сила на триене при покой и тялото започне да се движи
а) големина - правопропорционална на големината на силата на реакция на опората
- коефициент на триене при хлъзгане:
- сила на реакция на опората:
б) посока - перпендикулярна на силата на реакция на опората и обратна на посоката на движението
-
Сила на триене () - или силата на триене при покой, или силата на триене при хлъзгане (в зависимост от това дали вече е надмината максималната сила на триене при покой)
-
Нишка - магическа, неразтеглива, неповредима и безмасова връв
-
Сила на опън () - силата, с която действа нишката на всяко едно от телата, с които е свързана
а) големина - винаги е толкова, че двете тела, свързани с нишката да се движат по един и същ начин, т.е. с еднакво ускорение
б) посока - колинеарна с нишката, "към" нея
-
Импулс () - векторна величина, характеризираща количеството на движение на дадено тяло
-
Истински втори принцип на механиката
Доказателство:
-
Импулс на силата - промяната в импулса на тялото за определено време
-
Закони за импулса
а) запазване на импулса - когато на една система не действат външни сили, сумата от импулсите на нейните компонентни остава константна
Доказателство:
Всички сили в системата се проявяват като двойки сили с противоположна посока и еднаква големина.
Това е нула, защото всяка сила в сумата ще се унищожи със своята противоположна, а когато променливата на дадено нещо е нула, значи нещото е константа.
б) взаимодействие с външни сили - когато на системата действат външни сили, промяната в общия импулс е равна на сбора от външните сили
Доказателство:
Отново силите, които са вътрешни за системата, се проявяват като двойки сили с противоположна посока и еднаква големина и се унищожават в сумата -> остават само външните сили.
-
Център на масите - масовопретеглено средноаритметично на местоположенията на компонентите в дадена система
а) твърди тела с постоянна плътност
- ако тялото има геометричен център, центърът на масите съвпада с него
- ако тялото има ос на симетрия, центърът на масите се намира върху нея
-
Скорост на центъра на масите - скоростта на центъра на масите е общият импулс на системата върху общата маса
Доказателство:
-
Ускорение на центъра на масите - ускорението на центъра на масите е равно на сбора от външните сили върху общата маса на системата
Доказателство:
Силите, възникващи между самите тела се унищават в сумата и остават само силите , които са външни за системата.
-
Работа ()
а) на постоянна сила
б) на променлива сила
Доказателство:
За безкрайно малко преместване силата е приблизително постоянна и работата за това преместване е .
-
Кинетична енергия
а) връзка с работа - промяната в кинетичната енергия е равна на работата на действащата сила
Доказателство:
б) принцип на суперпозицията - работата на равнодействащата сила е равна на сбора на работите (като скалари) на всяка сила поотделно
Доказателство:
-
Потенциална енергия - работата, която дадена консервативна сила би извършила при преместването на тяло от дадена точка до нулевото равнище
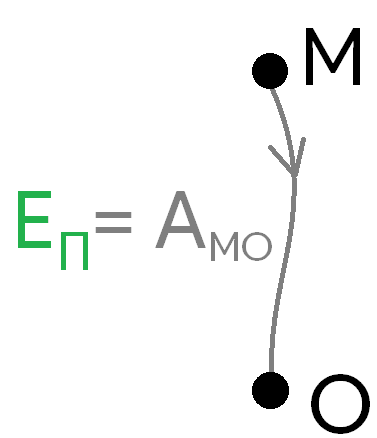 а) нулево равнище - точката в пространството, която приемаме, че има нулева потенциална енергия
а) нулево равнище - точката в пространството, която приемаме, че има нулева потенциална енергияб) консервативна сила - сила, за която може да се дефинира потенциална енергия
- работата на силата зависи само от разликата в местоположението, но не и от конкретната траектория на тялото
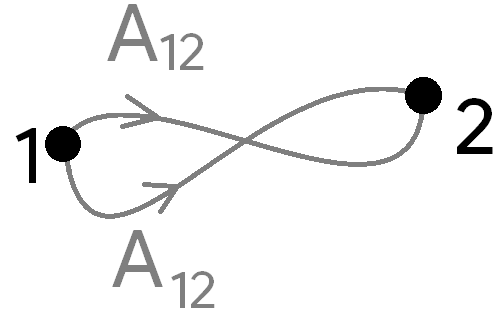
в) гравитационна потенциална енергия - работата, която гравитацията би извършила върху тяло, което пада от височина
- гравитационната потенциална енергия на система от тела (или на тяло, което не е материална точка) е същата все едно всичката маса на системата е съсредоточена в центъра на масите ѝ
г) еластична потенциална енергия
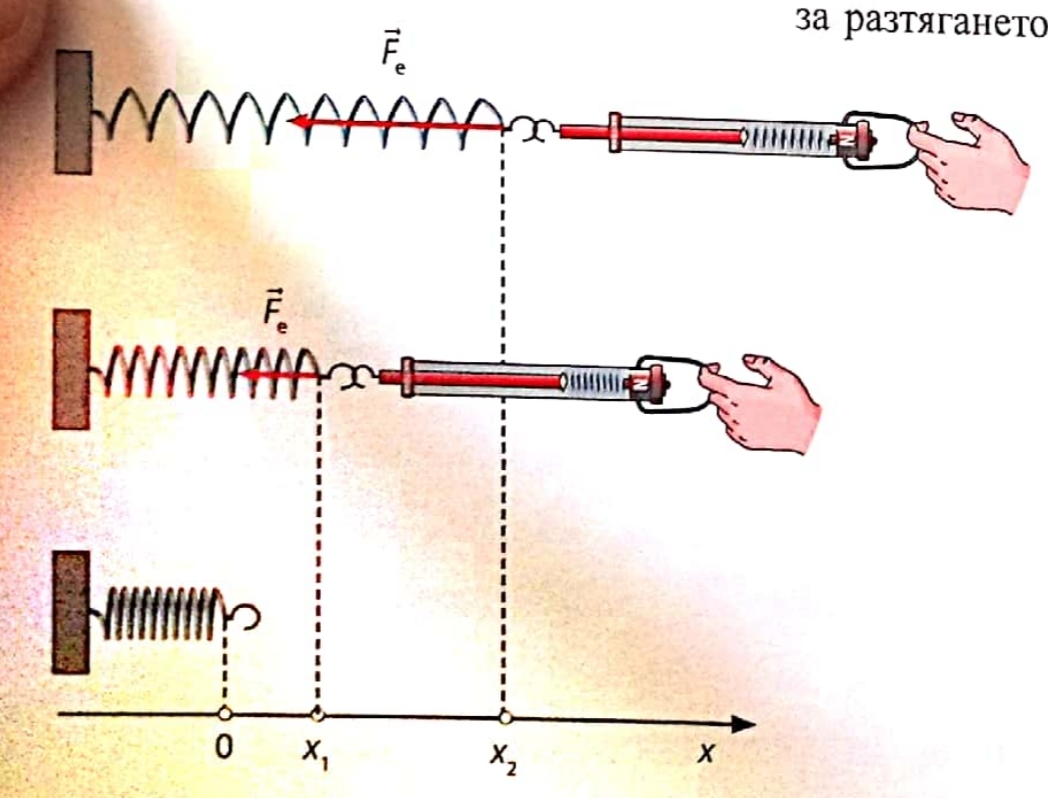
Доказателство:
По закона на Хук силата, с която действа пружината е . За безкрайно малко преместване тя извършва .
Тогава цялата работа, която силата ще извърши, премествайки пружината от позиция до равновесното положение е
- работата на силата зависи само от разликата в местоположението, но не и от конкретната траектория на тялото
-
Закон за запазване на енергията - сумата от кинетичната и потенциалната енергия и работата на неконсервативните сили в даден момент е равна на сумата на кинетичната и потенциалната енергия в следващия момент
Доказателство:
Работата на консервативните сили е равна на промяната на потенциалната енергия, със знак минус.
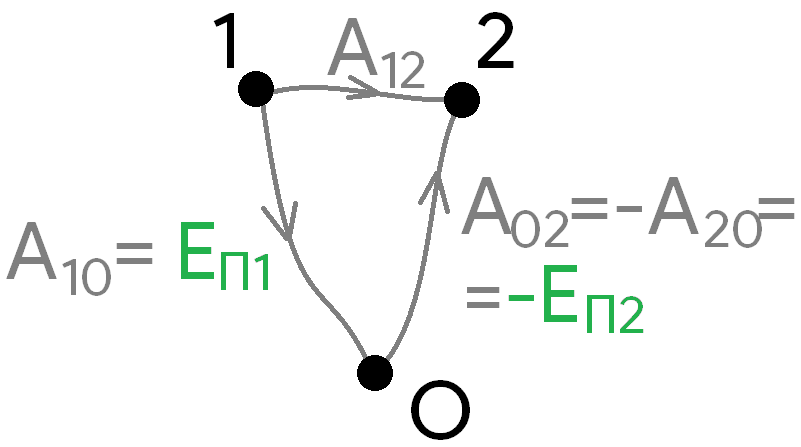
Използваме, че промяната на кинетичната енергия е равна на работата на всички сили, като отделяме от едната страна началната енергия, а от другата страна - крайната енергия
-
Закон за запазването на импулса при удари - сборът от импулсите на двете тела преди удара винаги е равен на сбора от импулсите на двете тела след удара
-
Удар - процес на пряко физическо взаимодействието между две тела, при което действат огромни сили за много кратко време
а) централен удар
- допирната точка на удара лежи на правата, свързваща центровете на масите на телата
- ударът не води до завъртане на телата
б) пряк удар
- скоростите са насочени противоположно една на друга
в) идеално еластичен удар - освен импулсът се запазва и енергията
- решаване на идеален еластичен удар
Доказателство:
Изразяваме чрез всичко останало от първото уравнение
Заместваме във второто уравнение, така че да остане само едно неизвестно ().
За да избегнем да смятаме дискриминанти, може да се сетим, че е решение и да разложим уравнението на нещо:
Делим на :
Връщаме се в първото уравнение, за да намерим :
г) идеално нееластичен удар - двете тела губят точно толкова енергия, че да започнат да се движат с еднаква скорост
-
Закон на Нютон за гравитацията - всяко тяло привлича всяко друго тяло със сила, правопропорционална на произведението на масите на двете тела и обратно пропорционална на квадрата на разстоянието между тях
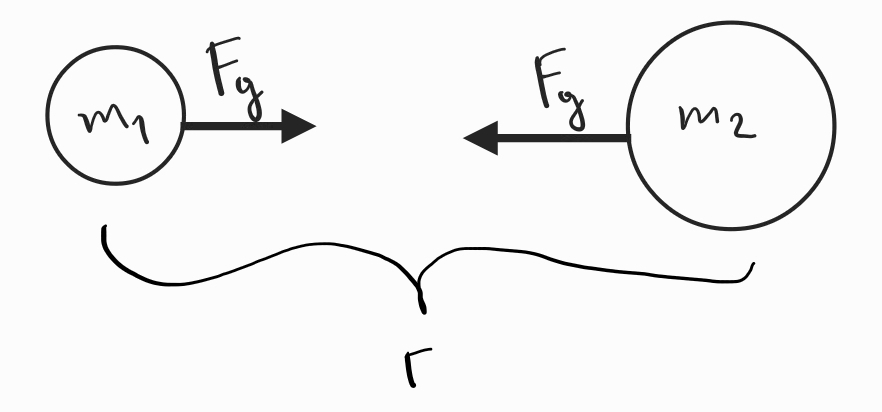
а) гравитационна константа
б) взаимодействие с еднородни сферични маси - гравитационното привличане, което едно тяло ще усети от еднородно сферично тяло е същото сякаш всичката маса на сферата е съсредоточена в центъра на сферата
-
Гравитационно поле - показва ускорението, с което едно тяло ще се движи поради гравитационното му взаимодействие с тяло с маса
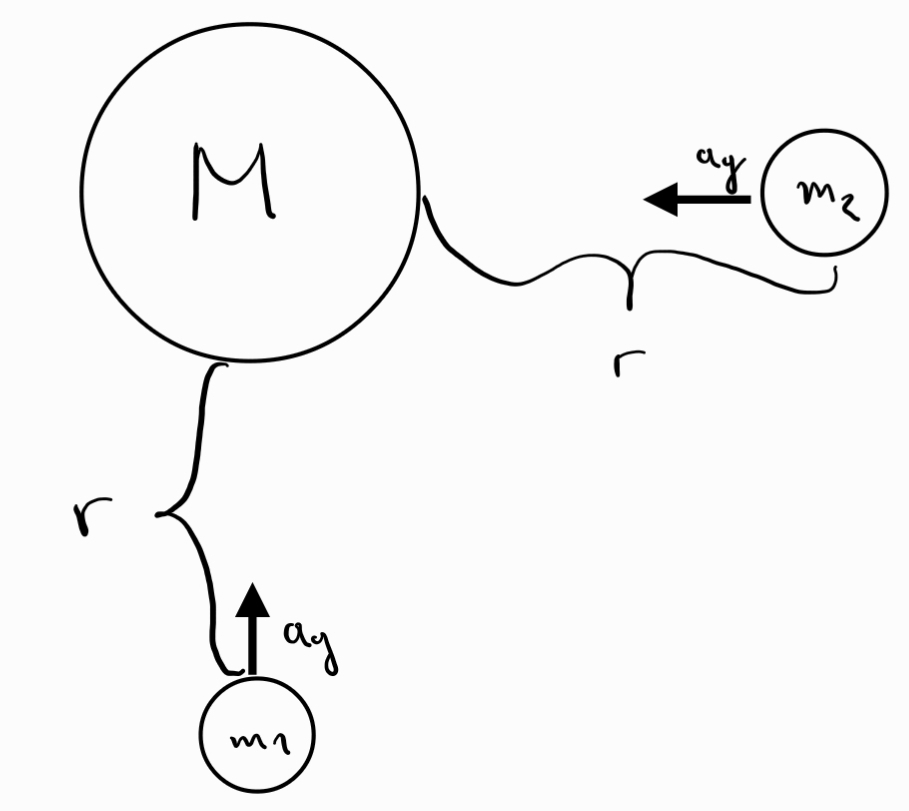
Всяко тяло, независимо от масата си, което се намира на разстояние от тяло с маса ще се движи с това ускорение.
Доказателство: За всяка маса гравитационното взаимодействие с има големина . В същото време силата на гравитацията е единствената сила, действаща върху и следователно
Тоест, ускорението не зависи от самата маса .
-
Гравитационна потенциална енергия - гравитационната сила е консервативна
а) нулево равнище - намира се в безкрайността
б) извеждане
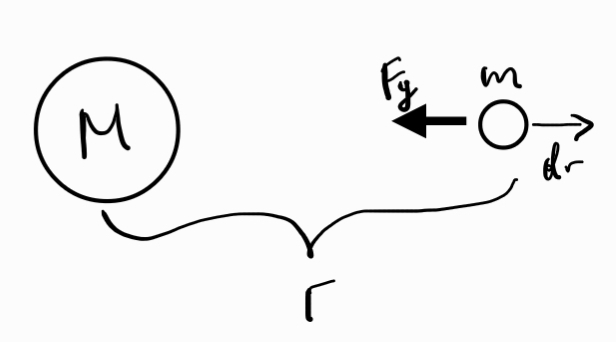
За преместване на безкрайно малко разстояние , силата на гравитацията върши работа , като минусът е там, защото тя действа противоположно на посоката на преместването. Тогава цялата работа за преместването на тялото до безкрайността (до нулевото равнище) се дава от формулата
-
Кръгова орбита - за да се движи едно тяло по кръгова орбита с определен радиус , то трябва да има точно определена тангенциална скорост
Доказателство: Силата на гравитацията е центростремителна, следователно
а) орбитален период - времето за изминаването на една обиколка по кръгова орбита
б) първа космическа скорост - тангенциалната скорост, с която едно тяло трябва да се движи, за да обикаля по повърхността на сферично тяло с радиус
-
Втора космическа скорост - скоростта, с която едно тяло трябва да се движи, за да преодолее напълно гравитационното си взаимодействие с друго тяло
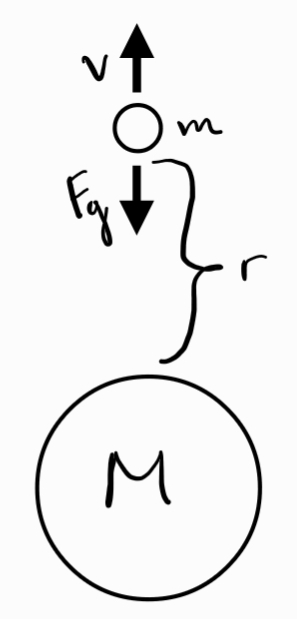 Доказателство: За да стане това, тялото трябва да има достатъчно кинетична енергия, че да спре чак в безкрайността, където и потеницалната енергия е нула
Доказателство: За да стане това, тялото трябва да има достатъчно кинетична енергия, че да спре чак в безкрайността, където и потеницалната енергия е нулаа) втора космическа скорост на Земята - скоростта, нужна на едно тяло, за да напусне Земята
-
Момент на импулса () - физична величина, характеризираща количеството въртеливо движение
а) на материална точка
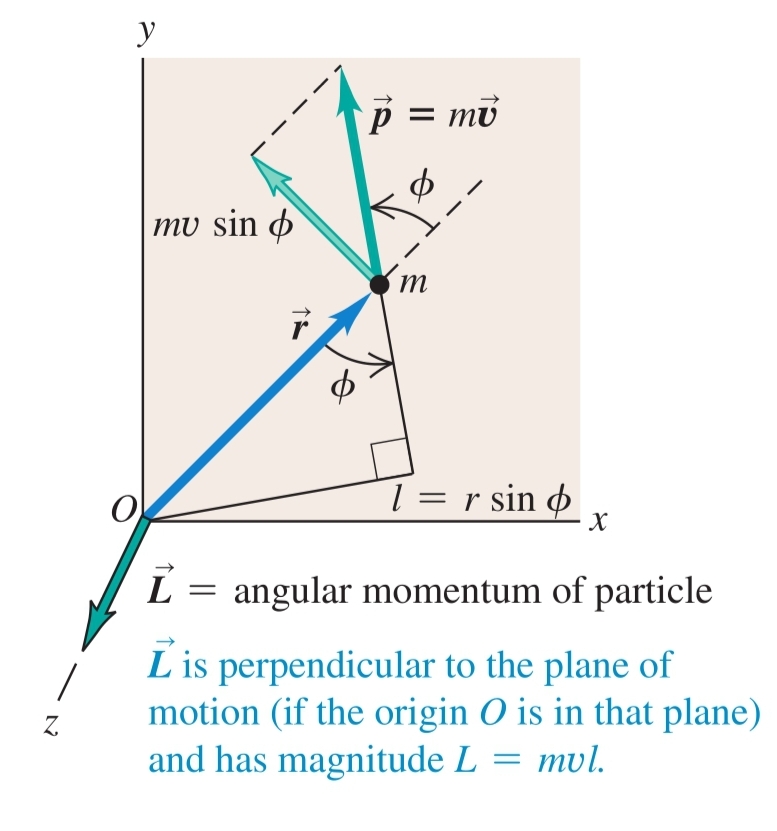
- посока - определя се по правилото на дясната ръка
- големина:
-
Въртящ момент / момент на сила () - величина, характеризираща въртеливото движение, което дадена сила придава на тялото, върху което въздейства
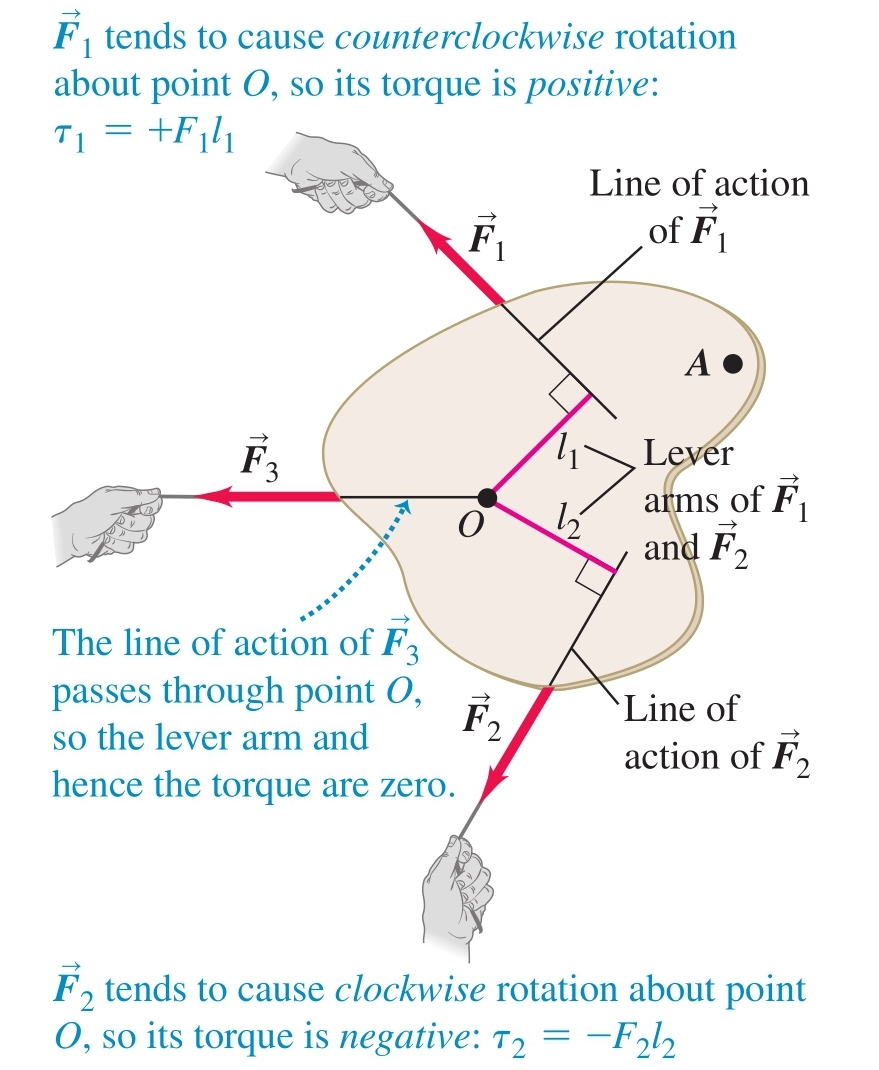
а) рамо на силата () - разстоянието между оста на въртене и правата, по която действа силата
б) големина
- сила, която действа така, че да завърти тялото по посока, обратна на часовниковата стрелка, има положителен въртящ момент
- сила, която действа така, че да завърти тялото по посока на часовниковата стрелка, има отрицателен въртящ момент
в) посока - палецът на дясната ръка сочи по посока на вектора на въртящия момент, когато останалите пръсти се насочат по посока на и се свият в посока на силата
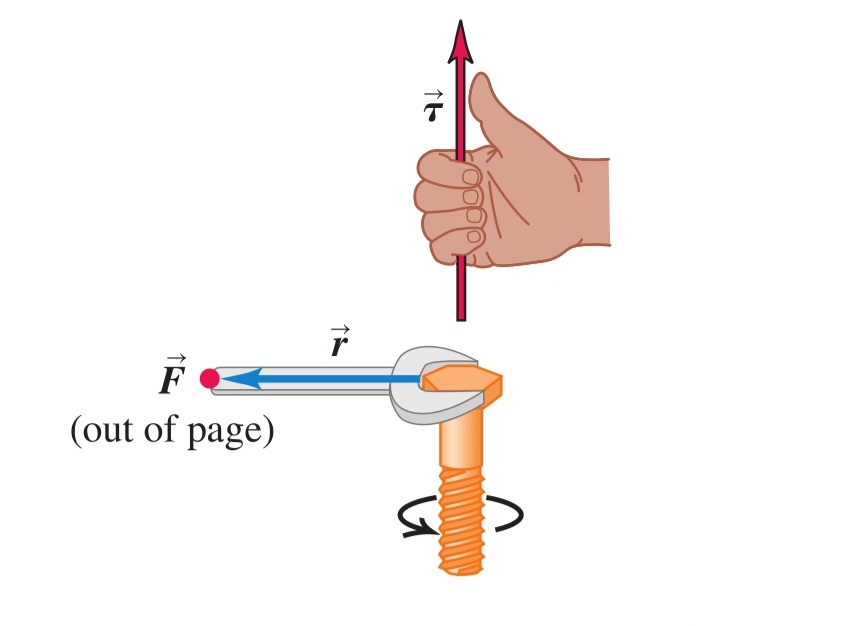
г) ефект върху момента на импулса - въртящият момент е промяната в момента на импулса
Доказателство:
-
Закон за запазване на момента на импулса - моментът на импулса в затворени системи остава постоянен във времето
Доказателство:
Промяната на момента на импулса на едно тяло е сбора от въртящите моменти, които му действат: Като съберем всички уравнения, ще имаме двойки въртящи моменти от вида
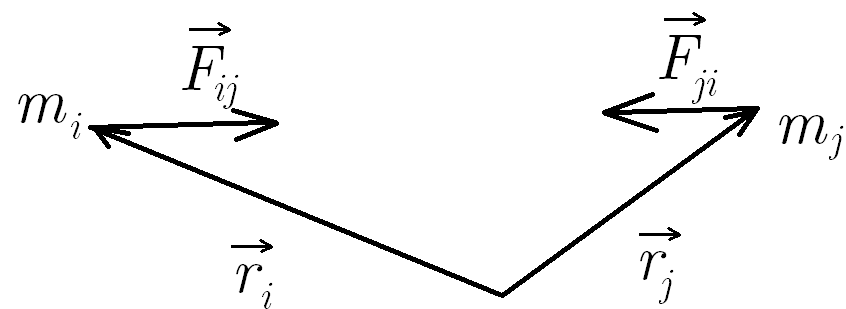 тъй като е колинеарна с . Като съкратим всички двойки въртящи моменти,
тъй като е колинеарна с . Като съкратим всички двойки въртящи моменти,
а) при отворени системи - производната на момента на импулса е равна на сбора от всички външни въртящи моменти
-
Идеално твърдо тяло - модел, който представя твърдите тела като множество от материални точки, неспособни на деформация
-
Инерчен момент () - мярка за инертността на тялото при завъртане около определена ос. За система материални точки
- разстояние до оста на въртене (в 3D не съвпада с радиус-вектора)
а) връзка с момента на импулса
Доказателство:
За една материална точка линейната скорост може да се изрази като . Моментът на импулса ѝ е . За цялата система
б) втори принцип на механиката за въртеливи движения
Доказателство:
в) теорема на Щайнер - връзка между инерчния момент около ос през центъра на масите и този около ос, перпендикулярна на нея
-
Инерчен момент на идеално твърдо тяло - тялото се разглежда като система от безбройно много материални точки и инерчният момент се изразява с интеграл
а) пръчка - с маса и дължина
- около центъра на масите на пръчката:
- около единия край на пръчката:
б) диск - с маса и радиус
- около центъра на масите:
в) сфера - с маса и радиус
- куха сфера (около центъра на масите):
- плътно кълбо (около центъра на масите):
-
Енергия на въртеливо движение - кинетичната енергия, която идеално твърдо тяло притежава само поради своето въртеливо движение
Доказателство:
Кинетичната енергия на -тата материална точка се дава от уравнението и всяка материална точка се движи с една и съща ъглова скорост.
Общата кинетична енергия е просто сумата на кинетичните енергии на всяка материална точка.
-
Енергия на комбинирано въртеливо и постъпателно движение - кинетичната енергия, която идеално твърдо тяло притежава поради своето въртеливо и постъпателно движение
Всяко движение на идеално твърдо тяло може да се разглежда като комбинация от постъпателно движение на центъра на масите и въртеливо движение около ос, минаваща през центъра на масите.
Както вече знаеш, ъгловата скорост е псевдовектор - посоката му е избрана по конвенция, което се случва всеки път, когато вкараме векторни произведения. Ако имаме материална точка с радиус-вектор , която се върти с ъглова скорост около ос, минаваща през центъра на координатната система, то скоростта ѝ е Моментът на импулса е Двойното векторно произведение може да се превърне в комбинация от скаларни и обикновени произведения Целта е да излезе пред скоби, но това продължава да не ни се получава - и може изобщо да не сочат в еднакви посоки. Обаче можем да представим това нещо като произведение на матрица по вектора : \begin{bmatrix} xx & xy & xz \ yx & yy & yz \ zx & zy & zz \end{bmatrix} \cdot \begin{bmatrix} \omega_x\\omega_y\\omega_z\ \end{bmatrix} = \begin{bmatrix} xx\omega_x + xy\omega_y + xz\omega_z \ yx\omega_x + yy\omega_y + yz\omega_z \ zx\omega_x + zy\omega_y + zz\omega_z \end{bmatrix} = \begin{bmatrix} x\ y\ z \end{bmatrix} (x\omega_x+y\omega_y+z\omega_z) Деф. Тензорно произведение на векторите и е обектът \vec a\otimes\vec b = \begin{bmatrix} a_xb_x & a_xb_y & a_xb_z \ a_yb_x & a_yb_y & a_yb_z \ a_zb_x & a_zb_y & a_zb_z \end{bmatrix} е -тата компонента на тензора . Векторите се характеризират с 3 компоненти, но те зависят от координатната система. За да бъде един обект вектор, то трябва не просто да има три компоненти, а и те да се преобразуват по точно определен начин при смяна на координатната система. Аналогично нещо важи и за тензорите.
Физичният смисъл на тензорите е, че изобразяват един вектор в друг. Деф. Скаларно произведение на тензор с вектор е векторът с компоненти . Ако напишем и като матрици-стълбове, това равенство съответства точно на матрично умножение.
Деф. Символ на Кронекер: \hat \delta =\begin{bmatrix} 1 & 0 & 0 \ 0 & 1 & 0 \ 0 & 0 & 1 \end{bmatrix} \delta_{ij} = \cases{1, i = j\ 0, i \neq j} Тогава можем да представим като
Деф. Тензор на инерчния момент на система от материални точки е За една материална точка \hat I = m \begin{bmatrix} y^2+z^2& -xy & -xz\ -yx& x^2+z^2 & -yz\ -zx& -zy & x^2+y^2\ \end{bmatrix} Забележи, че е симетрична матрица.
Деф. е собствен вектор (eigenvector) на матрицата със собствена стойност (eigenvalue) , ако . Геометричен смисъл - действието на матрицата е някаква трансформация на пространството. По направление на обаче тя представлява само разтягане (без завъртане) пъти.
Свойство. Собствените вектори на симетричните матрици са перпендикулярни. Док. Взимаме два различни собствени вектора: Или , т.е. векторите са перпендикулярни, ли , т.е. векторите имат еднаква собствена стойност и или са колинеарни, или за цялата равнина, в която лежат, и тогава от тази равнина можем да си изберем перпендикулярни собствени вектори.
Свойство. Собствените стойности на реалните симетричните матрици са реални числа. Док. при .
Свойство. Собствените стойности на матрица са решенията на уравнението . Обяснение. Детерминантата на една матрица показва колко пъти се променят обемите от пространството под действие на матрицата. Ако детерминантата е 0, то пространството се смачква до 0 в някоя посока, т.е. става най-много - мерно. Значи има вектори , които под действие на се превръщат в
е уравнение от трета степен има 3 корена, които дават 3 собствнеи стойности. Понеже е симетрична, собствените стойности са реални и собствените вектори са перпендикулярни. Нека минем в отправна система с оси, насочени по посока на трите собствени стойности. Тогава \hat I = \begin{bmatrix} I_{xx}&0&0\ 0&I_{yy}&0\ 0&0&I_{zz} \end{bmatrix} = m \begin{bmatrix} y^2+z^2&0&0\ 0&x^2+z^2&0\ 0&0&x^2+y^2 \end{bmatrix} и са си точно разстоянията на материалната точка съответно до осите , и . Тези оси се наричат главни инерчни оси.
-
Периодично движение - движение, което се повтаря равномерно във времето
-
Характерни величини
а) амплитуда () - максималното отклонение от равновесното положение
б) период () - времето, за което системата от всяко едно положение се завръща в същото положение
в) честота () - броят цикли за единица време
г) кръгова честота
- връзка с периода:
-
Хармонично трептене - трептене, при което позицията като функция на времето представлява синусоида
а) параметри
- амплитуда () - максималното отклонение от равновесното положение
- кръгова честота () - определя честотата, с която се повтаря движението
- начална фаза () - показва началното положение на трептящата система
б) скорост
- максимална скорост:
в) ускорение
- максимално ускорение:
-
Динамика на хармоничното трептене - за да трепти едно тяло с маса хармонично, трябва да му действа сила, пропорционална на отместването от равновесното състояние и обратна на посоката му
а) ускорение
б) кръгова честота и период
-
Математично махало - идеализиран модел на махало, представляващ материална точка, свързана с безмасова неразтеглива нишка
-
Динамика на математичното махало
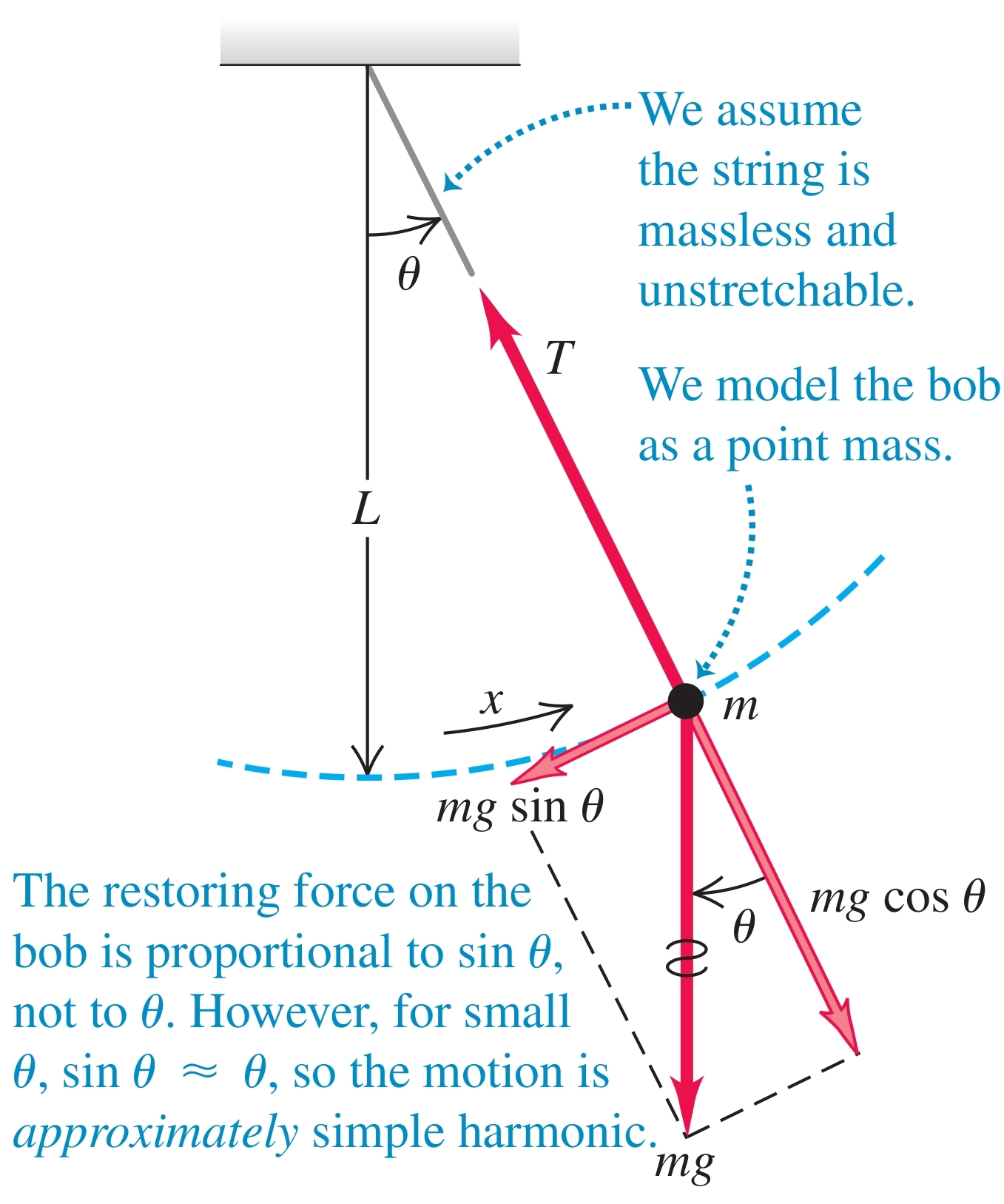
а) връщаща сила - пропорционална на
- за малки ъгли и трептенето е приблизително хармонично
б) кръгова честота
Доказателство:
в) период
-
Флуид - вещество, което може да тече и да променя формата си
а) течност - флуид, който може да променя формата на обема си, но не и самия обем
- некомпресируемост - налягането върху течността има незначителен ефект върху нейния обем
б) газ - флуид, който може да променя и формата, и самия обем
в) идеален флуид - некомпресируем флуид без вискозитет (вътрешно триене)
-
Плътност () - масата, съдържаща се в единица обем
а) свойства
- неща, направени от един и същ материал, имат една и съща плътност
-
Налягане () - перпендикулярната сила, която флуидът упражнява върху дадена повърхност
а) мерни единици
б) налягане на флуид - самият флуид упражнява налягане върху всеки свой безкрайно малък сегмент

в) закон на Паскал - налягане, което се упражнява върху флуид в затворен съд, се предава до всяка точка на флуидаи стените на съда
г) зависимост от дълбочината
- - налягането на дълбочина
- - налягането над повърхността на флуида
- - плътността на флуида
-
Структура на движението
а) токова линия - крива, която е допирателна във всяка своя точка към скоростта на флуидна частица в същата точка
- стационарен флуид - флуид, чиито токови линии остават непроменени във времето
б) токова тръба - повърхност, съставена от токови линия
-
Видове движение на флуид
а) ламинарно течение - постоянен поток на флуида, чиито отделни слоеве не взаимодействат помежду си
б) турбулентно течение - хаотично движение на флуида, което започва след достигането на опрелена скорост
- колкото по-висок е вискозитетът на флуида, толкова по-трудно той може да тече турбулентно
-
Поток () - обемът флуид, който преминава през дадено напречно сечение на съда за единица време
a) скоростта на флуида е перпендикулярна на сечението и еднаква в рамките на него:
Доказателство:
За време флуидът изминава път и изтеклият флуид през сечението сега се намира в цилиндър с обем
б) скоростта сключва ъгъл с перпендикуляра към площта:
Доказателство:
Потокът е същият като през проекцията на площта , перпендикулярна на скоростта.
Тъй като ъгълът между равнината на и равнината на е , .
Ако въведем вектор на площта с големина и посока - перпендикулярна на площта, то
в) произволна крива повърхност, различни скорости в рамките на повърхността:
Доказателство:
За всяко безкрайно малко парче от площта може да приемем, че е приблизително плоско и скоростта е еднаква в рамките на парчето. Тогава потокът през това парче е . Целият поток е
-
Уравнение на непрекъснатост - потокът на идеален флуид е постоянен
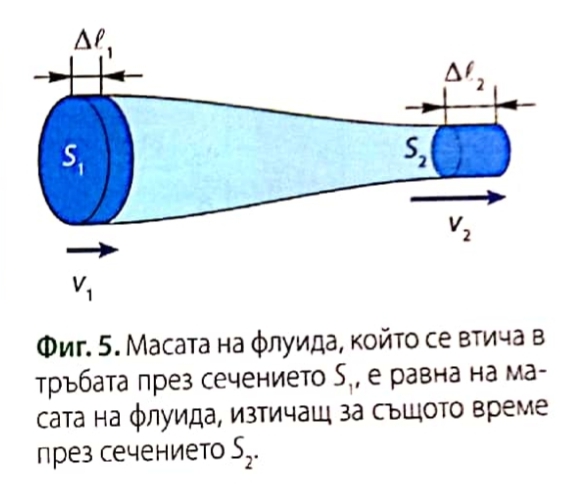
- през по-тесни участъци флуидът тече по-бързо
Доказателство (с щипка лъжи):
Идеалният флуид е некомпресируем - между двете напречни сечения не може да се струпва маса, защото това би променило плътността
-
Уравнение на Бернули - закон за запазване на енергията на идеален флуид
-
Вискозитет () - величина, характеризираща степента на вътрешното взаимодействие между слоевете на даден флуид
-
Закон на Нютон - всеки слой от флуида действа на заобикалящите го слоеве със сила, която се опитва да изравни тяхната скорост с тази на дадения слой и която зависи от скоростта?, големината на допирната повърхност на слоевете и вискозитета
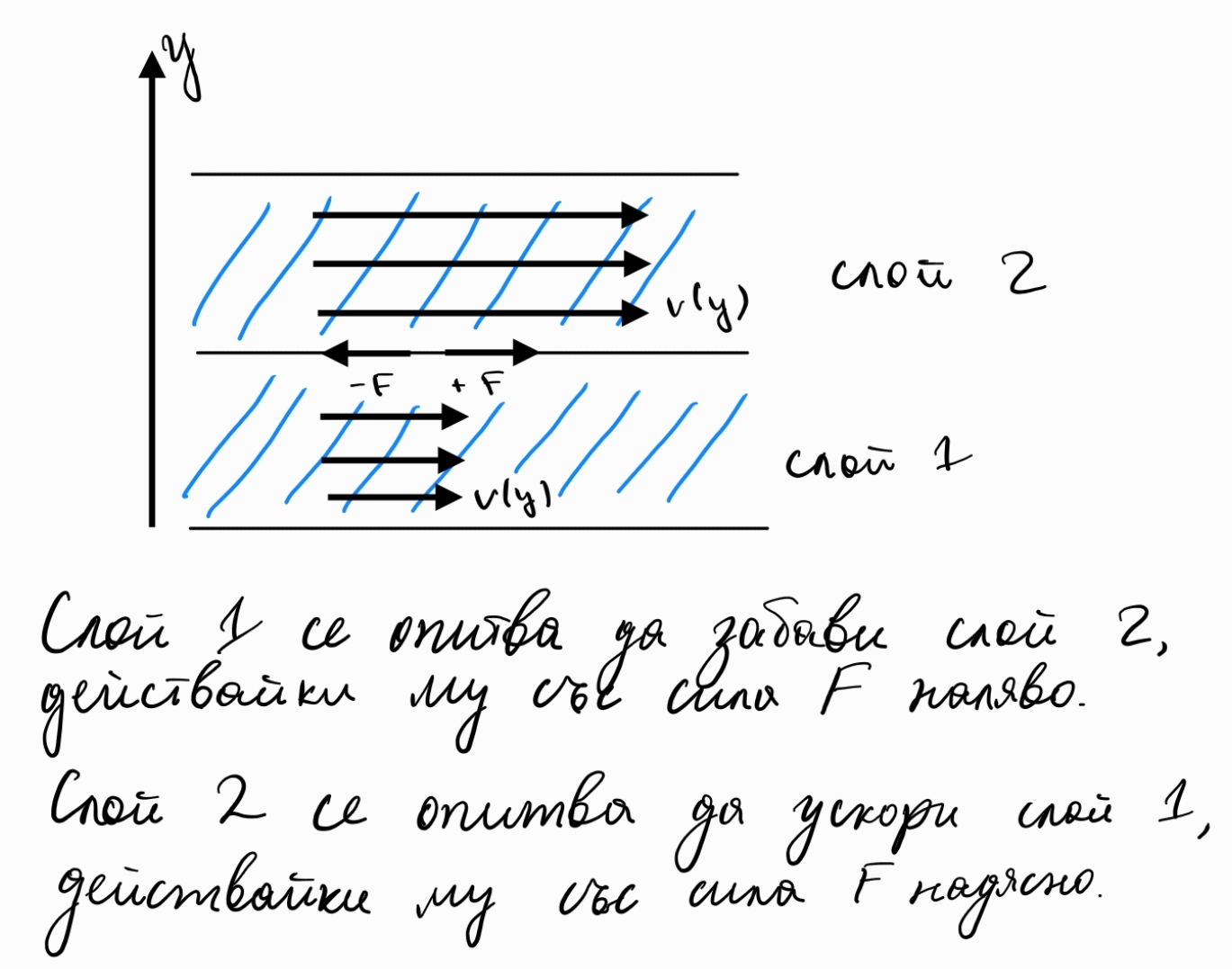
-
Закон на Хаген-Поазьой - за потока на вискозен флуид в тръба, в чиито краища е приложено различно налягане
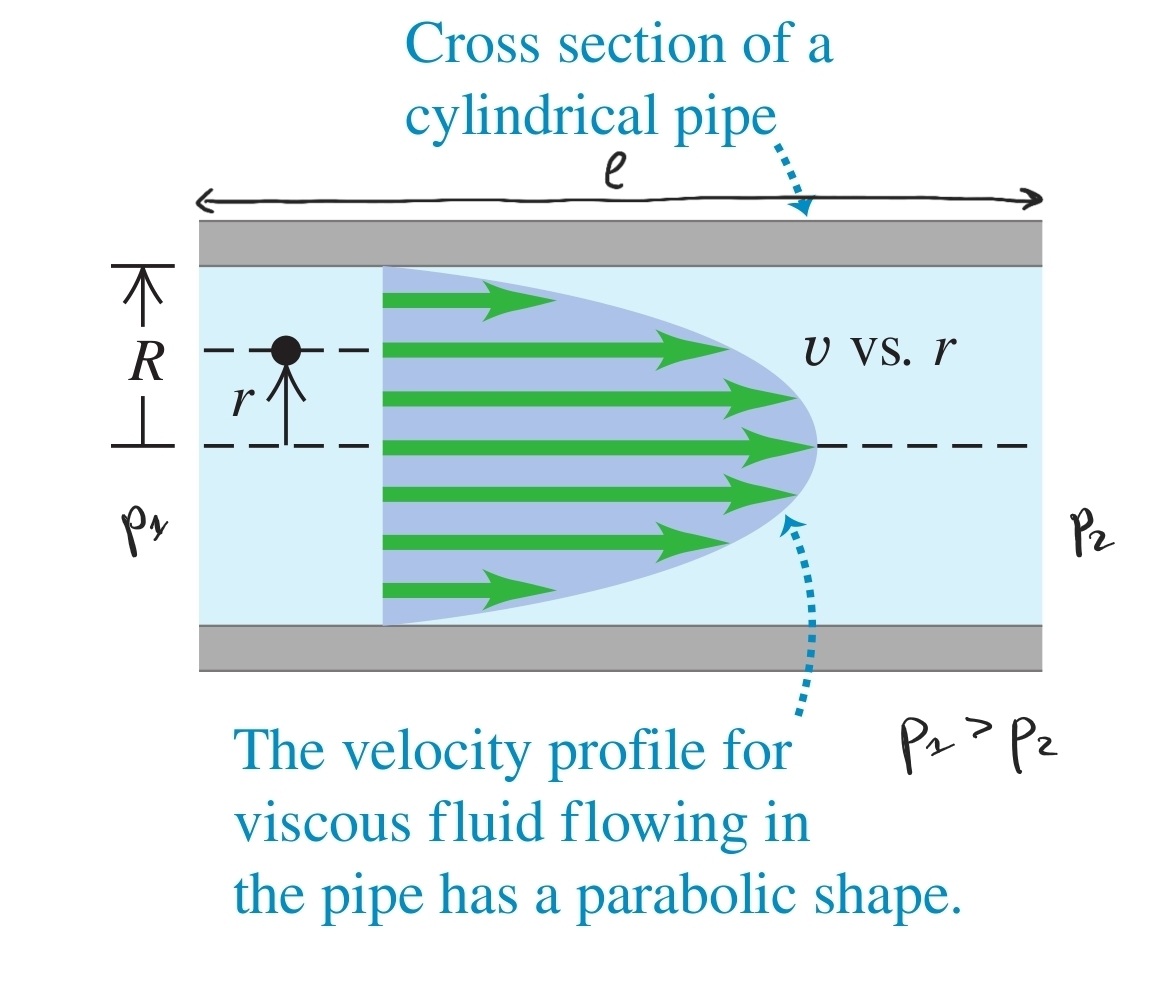
Доказателство: пас
-
Парадокс на д'Алямбер - на тяло, движещо се в идеален флуид, не действа съпротивление
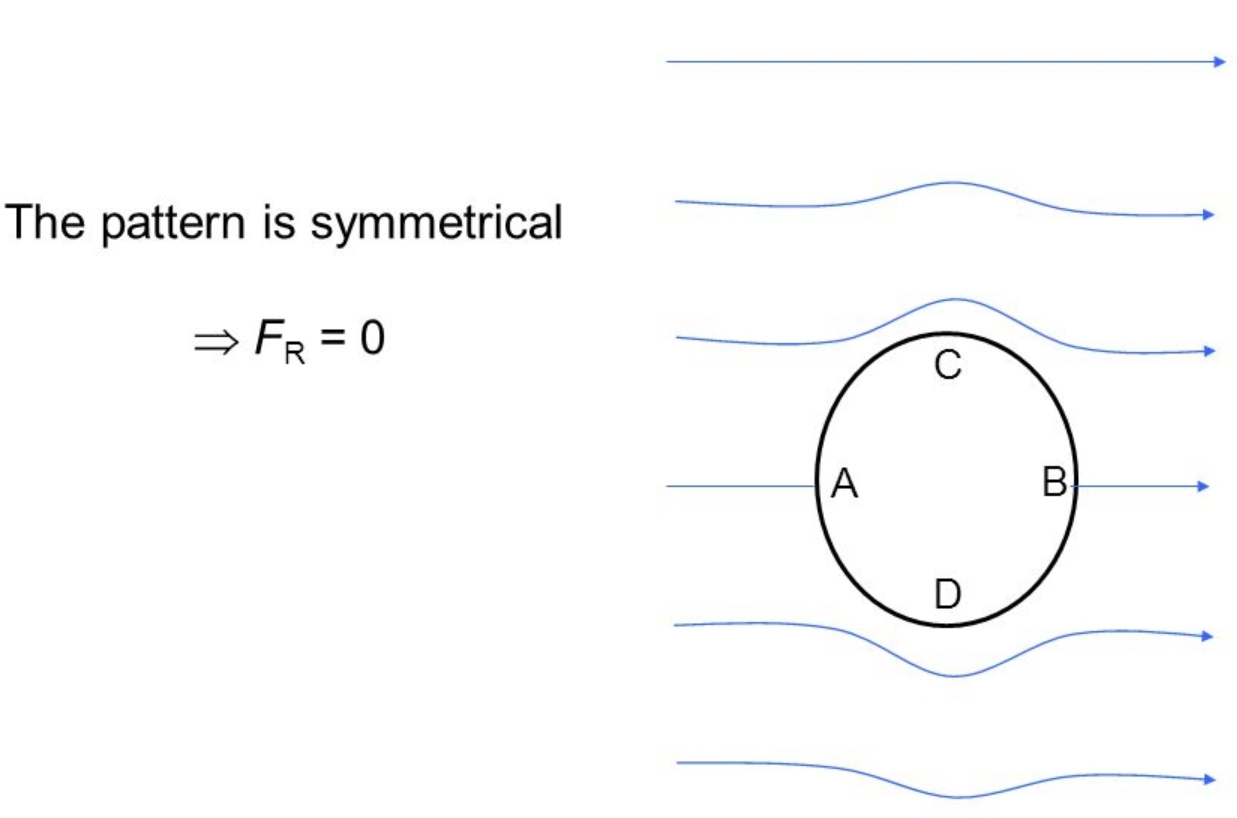
-
Движение във вискозен флуид
а) число на Рейнолдс () - безразмерен коефициент, даващ оценка дали движението на флуида е ламинарно или турбулентно
- ламинарно течение:
- турбулентно течение:
б) движение в ламинарно течение
- закон на Стокс - флуидът оказва следната сила на съпротивление върху сферично тяло с радиус , движещо се със скорост
в) движение в турбулентно течение - флуидът оказва сила на челно съпротивление върху тялото, която зависи от неговата форма, скоростта, с която то се движи, повърхността на напречното му сечение и плътността на флуида
г) подемна сила - силата, която не знам
-
Плавателност
а) закон на Архимед - флуидът упражнява сила нагоре върху всяко тяло, потопено в него, която е равна на тежестта на изместения от тялото флуид
б) плаване
- - тялото плава на повърхността на флуида и е само частично потопено
- - тялото плава точно под повърхността на флуида и е напълно потопено в него
- - тялото потъва на дъното
-
Електричен заряд () - величина, характеризираща свойството на телата да участват в електромагнитно взаимодействие
а) видове
- положителен
- отрицателен
б) елементарен заряд - най-малкият (по абсолютна стойност) електричен заряд, съществуващ самостоятелно в природата
-
Закон за запазване на електричния заряд - в електрически изолирана система алгебричната сума от електричните заряди остава постоянна във времето
-
Сила на електрично взаимодействие - възниква между всеки две тела с ненулев електричен заряд
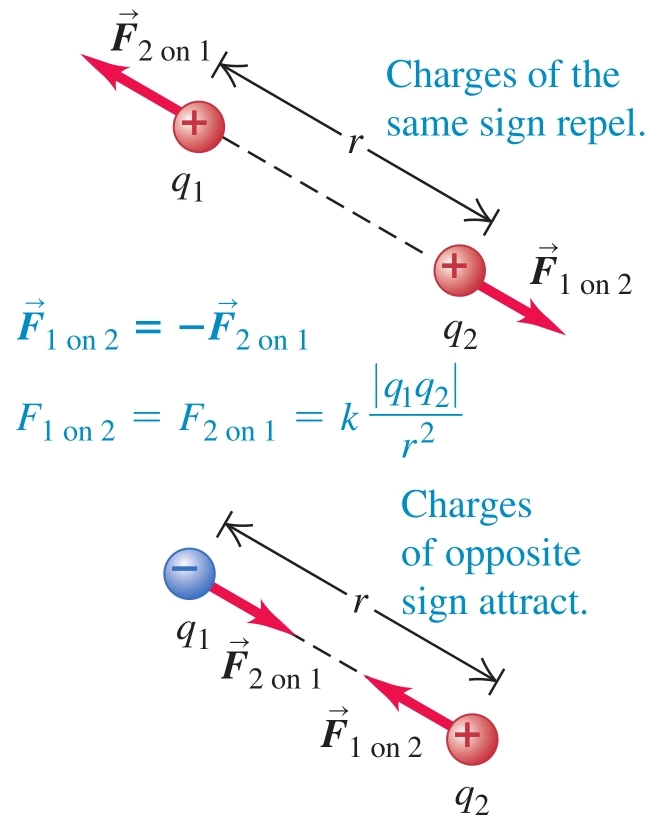
а) посока - силата винаги действа по правата, свързваща центровете на масите на двете тела
- между заряди с еднакъв знак - силата ги отблъсква
- между заряди с различен знак - силата ги привлича
б) големина - закон на Кулон
- константа на Кулон (във вакуум):
-
Плътност на заряда () - величина, характеризираща гъстотата на електричния заряд
а) повърхнинна плътност на заряда ()
б) обемна плътност на заряда ()
-
Електрично поле - всеки заряд създава електрично поле около себе си
а) силови линии - начин за графично изобразяване на електрично поле
- винаги излизат от положителни заряди
- винаги влизат в отрицателни заряди
-
Интензитет() - физична величина, характеризираща електричното поле, което заряд създава в точка с радиус вектор от позицията на заряда
а) принцип на суперпозицията - общият интензитет на електричното поле в дадена точка е равен на векторната сума на интензитетите на всичките електрични полета в тази точка
-
Заряд в електрично поле - върху всеки заряд , намиращ се в електрично поле с интензитет , действа сила на електрично взаимодействие
-
Диелектрична проницаемост на вакуума () - величина, характеризираща колко лесно електростатичното поле се разпространява във вакуум
-
Поток на електрично поле () - физична величина, пропорционална на броя силови линии, които преминават през дадена повърхност
а) закон на Гаус - потокът, минаващ през затворена повърхност, която ображда заряд, зависи само от обрагдения заряд
-
Електрично поле в и извън някои обекти
а) електрично поле на заредена сфера - има се предвид сфера с постоянна повърхнинна плътност на заряда
- вътре в сферата интензитетът на електричното поле е нула
- извън сферата интензитетът е същият като този, който би се породил, ако целият заряд на сферата беше съсредоточен в нейния център
б) електрично поле на заредено кълбо - има се предвид кълбо с постоянна обемна плътност на заряда
- извън кълбото интензитетът е същият като този, който би се породил, ако целият заряд на кълбото беше съсредоточен в неговия център
- вътре в кълбото интензитетът в даден концентричен сферичен участък е същият като този, който би се породил, ако се игнорират външните сферични пластове на кълбото и се вземат предвид само вътрешните за сферичния отрязък такива
в) електрично поле в близост до заредена пластина - става дума за пластина с постоянна повърхнинна плътност на заряда
-
Електрична потенциална енергия
Доказателство
Извеждането е аналогично на гравитационната потенциална енергия; сега обаче едноименните заряди се отблъскват и енергията им е положителна.
-
Електричен потенциал () - физична величина, характеризираща потенциалната енергия, която даден заряд ще получи, когато е поставен в електростатично поле
а) пораждане - всеки заряд изпълва заобикалящото го пространство с потенциал
- зарядът създава на разстояние от себе си следния потенциал
б) принцип на суперпозицията - общият потенциал в дадена точка от пространството е равен на сумата на потенциалите, които всички заряди в системата създават в тази точка
в) мерна единица - волт
-
Напрежение () между точките и - разликата в потенциалите в тези две точки
а) напрежение между две точки в еднородно електрично поле
- полето трябва да е еднородно
- точките трябва да лежат на права, успоредна на силовите линии
-
Проводник - материал с голям брой свободни електрични заряди
-
Проводник в електростатично поле
а) вътре в проводника - когато проводникът се постави във външно електростатично поле, от едната му страна се трупат положителните заряди, а от другата - отрицателните, и те създават електрично поле в обратната посока, което неутрализира външното
- интензитетът на електростатичното поле е нула
- във вътрешността на проводника няма заряд
- потенциалът е константен
б) на повърхността на проводника - интензитетът на електростатичното поле е перпендикулярен на повърхността на проводника
- потенциалът е константен
- всички заряди се индуцират на повърхността
- около ръбовете на проводника се индуцират големи заряди
-
Електричен дипол - система от два противоположни заряда, които се намират на много късто разстояние един от друг

а) диполен момент () - вектор, сочещ от отрицателния към положиетлния заряд
б) дипол в електрично поле - върху двата краища на дипола действат сили, които създават въртящ момент, който се стреми да ориентира дипола по посока на електричното поле
-
Диелектрик - вещество с много малък брой свободни заряди
-
Поляризация на диелектриците - молекулите в диелектрик, поставен във външно поле , се завъртат така, че създават собствено електрично поле , в посока, противоположна на . Общото електрично поле се оказва пропорционално на .
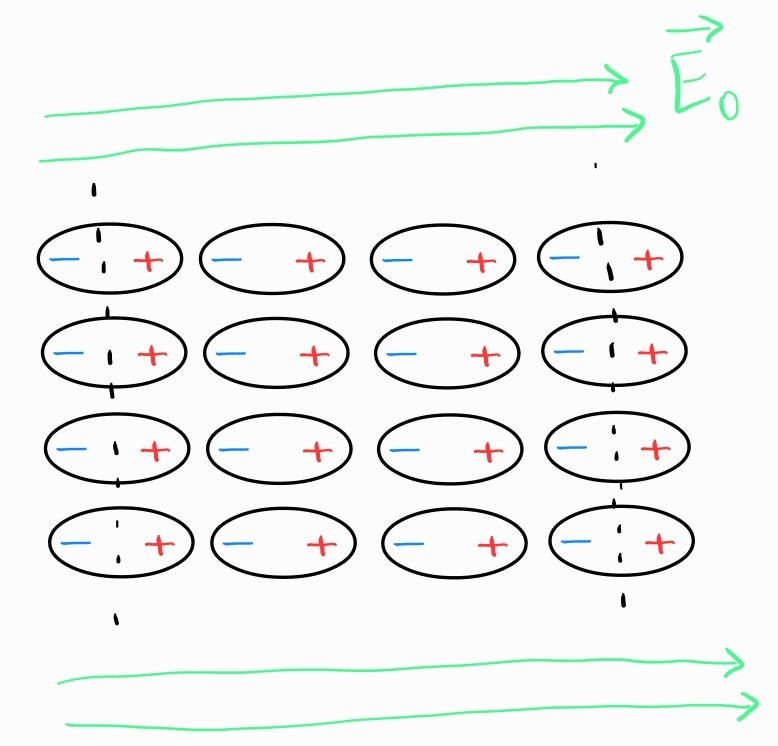
а) относителна диелектрична проницаемост () - отношението между магнитуда на първоначалното електрично поле към отношението на магнитуда на последвалото общо електричното поле
- заряд в диелектрик в електрично поле -
б) диелектрична проницаемост на средата
-
Заряд в диелектрична среда - заедно с диелектричната среда с проницаемост ще създадат поле, което е по-слабо от това, което щеше да създаде зарядът във вакуум
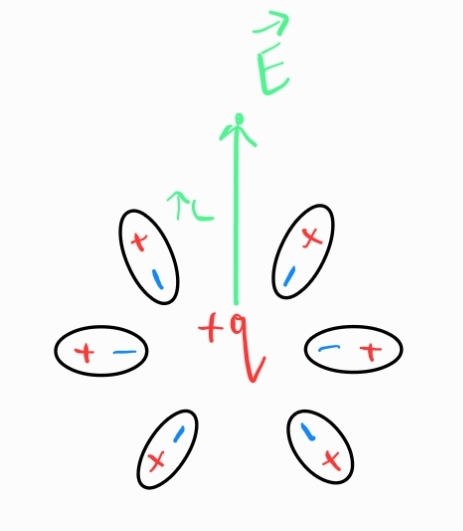
-
Електричен ток - насочено движение на електрични заряди под действието на електрично поле
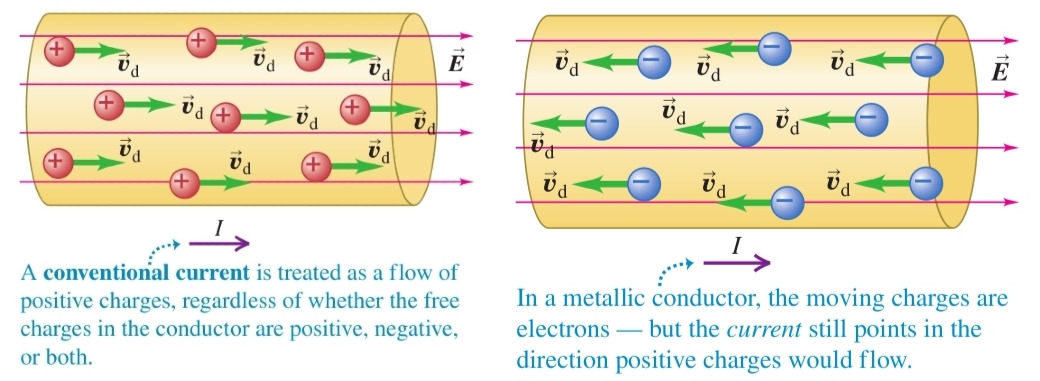
а) посока
- конвенционален ток - приема движещите се заряди за положителни, т.е. тече в посока, обратна на движението на отрицателните заряди
б) големина ()
- мерна единица - ампер
в) дрейфова скорост () - средната скорост на насоченото движение на зарядите
- пропорционална на интензитета на електричното поле
г) зависимост
- от
-
Плътност на тока ()
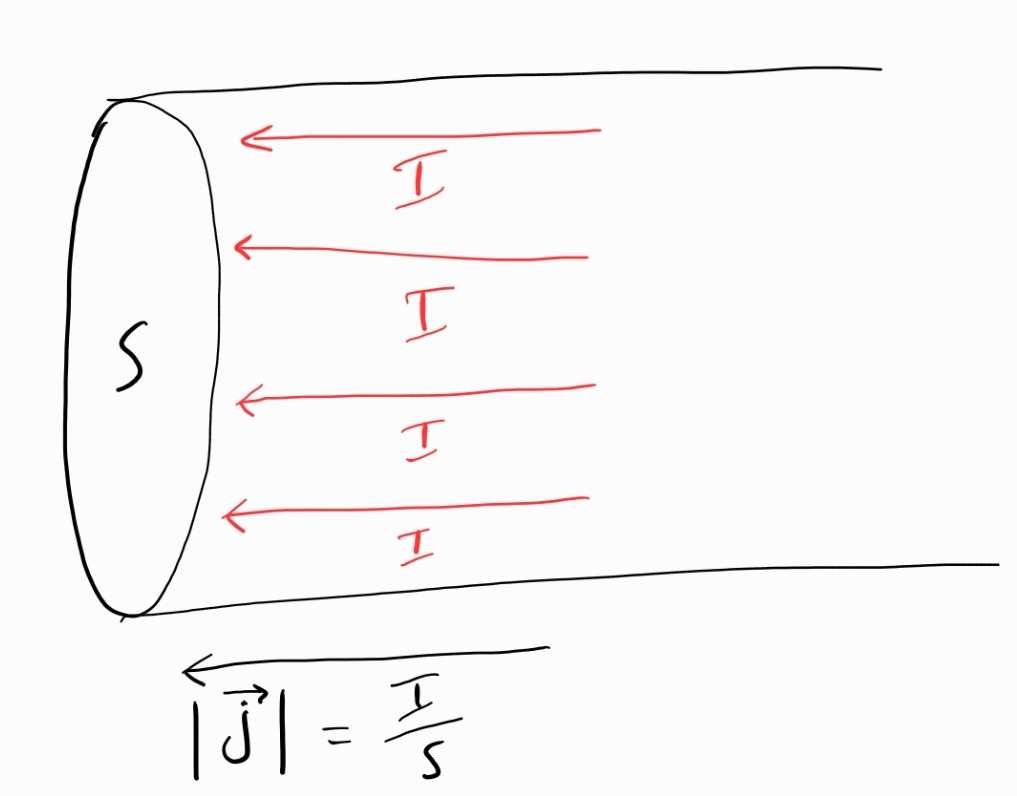
а) посока - посоката на конвенционалния ток
б) големина - токът върху лицето на напречното сечение на проводника
- концентрация на свободните заряди в проводника () - броят на свободните заряди за единица обем на проводника
- заряд на свободните заряди () - зарядът на всеки един свободен заряд
-
Съпротивление - докато се движат по проводника зарядите се сблъскват с другите частици, което изглежда като сила на съпротивление
а) специфично съпротивление ()
- зависи от електричното поле и материала на проводника
- колкото по-голямо е специфичното съпротивление, толкова по-силно електрично поле е нужно, за да създаде определена плътност на тока
б) съпротивление () - на проводник с напречно сечение , дължина и специфично съпротивление
- мерна единица - ом
в) закон на Ом - за ток, който тече през проводник със съпротивление под напрежение
-
Електричен ток в различни среди
а) концентрация на токовите носители () - характерна за средата величина, показваща броя токови носотели, намиращи се в единица обем от средата
- елементарен заряд:
- дрейфова скорост на токовите носители:
- напречно сечение на проводника:
а) ток в метали
- металите са отлични проводници - имат специфично съпротивление много по-малко от 1,\ohm\cdot\text{m} (обикновено около от порядъка на )
- специфичното съпротивление нараства с покачване на температурата - зависи от температурния коефициент на съпротивление
б) ток в изолатори
- изолаторите практически не провеждат електричен ток - имат специфично съпротивление от порядъка на 10^{-10} ,\ohm\cdot\text{m} и нагоре
- възможно е протичането на ток при много силни електрични полета, които предизвикват електричен пробив
в) ток в полупроводници
- провеждат ток при определени условия - имат междинни стойности на специфично съпротивление
- специфичното съпротивление намалява с покачване на температурата - в интервал от температурна разлика е в сила същият закон като при металите, но
г) ток в свръхпроводници
- някои вещества губят напълня специфичното си съпротивление при изключително ниски температури
-
Електрична верига - начин на свързване на източници на напрежение и консуматори чрез проводници
а) електрична схема - опростен графичен начин за представяне на електрични вериги
-
Източник на напрежение - обект, който поддържа постоянна потенциална разлика между двата си полюса
а) обозначение

- положителният полюс (този с по-висок потенциал, защото се преструваме, че се движат положителни заряди) се означава с удължена чертичка и плюс
- напрежението на източника се бележи с
- вътрешното съпротивление на източника се бележи с
б) вътрешно съпротивление () - източниците на напрежение не са съвършени и в електричната верига създават напрежение , което е по-ниско от вътрешното напрежение на източника, и зависи от тока, който тече по веригата
-
Консуматор - устройство, вързано към електрична верига, което използва електричната енергия по някакъв начин
-
Резистор - вид консуматор с постоянно съпротивление, който регулира тока, минаващ през веригата
а) обозначение

- върху или под резистора се бележи неговото съпротивление
-
Механизъм на електричните вериги - потенциални разлики
Потенциалът се изменя само във вътрешността на консуматорите и източниците на напрежение. Навсякъде другаде по проводника потенциалът е един и същ и зависи от консуматорите, свързани чрез този участък от проводника.
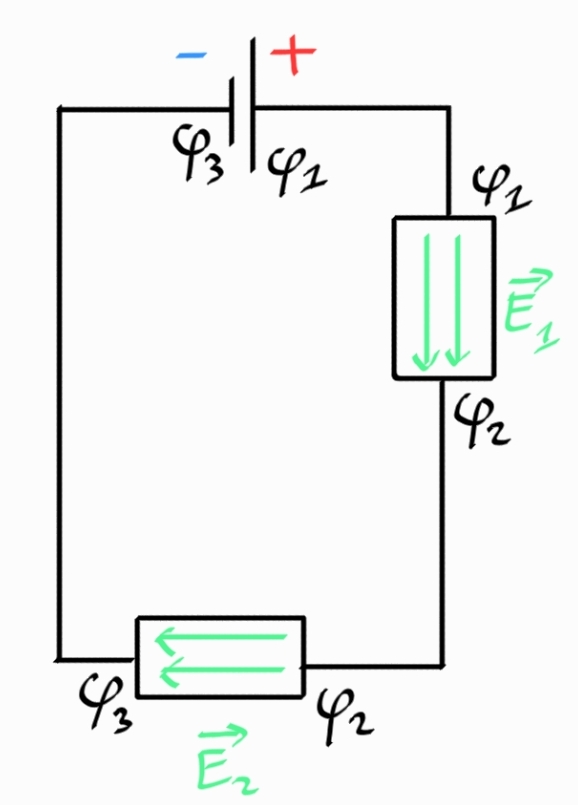
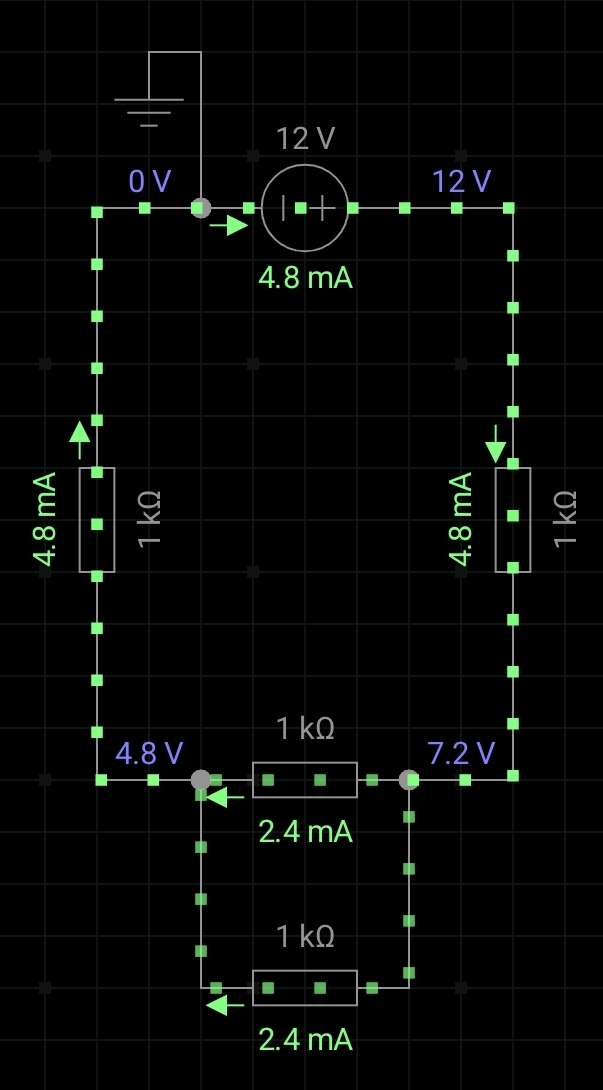
-
Начини на свързване
а) последователно свързване - консуматорите са свързани последователно един след друг чрез проводници и токът изминава един единствен път
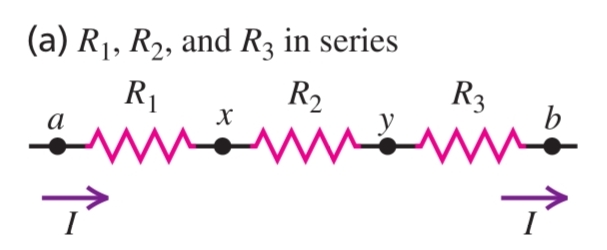
- ток - токът, който тече през последователно свързани консуматори е един и същ
- напрежение - общото напрежение между началото и края на веригата последователно свързани консуматори е сборът от напреженията между всяка двойка консуматори, свързани директно с проводник
б) успоредно свързване - консуматорите са свързани по такъв начин, че токът се разделя и следва повече от един път
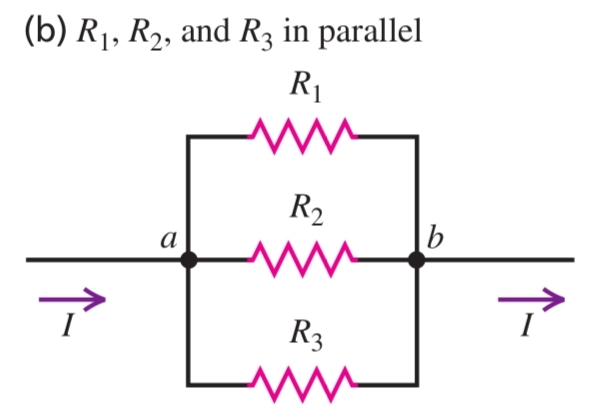
- ток - сборът от тоците, влизащи във всеки консуматор, е равен на сбора от тоците, излизащи от консуматорите
- напрежението между краищата на всеки консуматор е едно и също за всички консуматори
-
Еквивалентно съпротивление - всяка комбинация от резистори със съпротивления може да се замени с един еквивалентен резистор със съпротивление
а) на последователно свързани резистори
б) на успоредно свързани резистори
-
Закони на Кирхов
а) закон за тока - за всеки възел във веригата
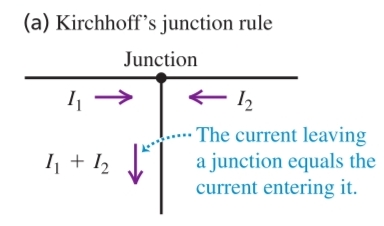
б) закон за напрежението - за всеки затворен цикъл във веригата
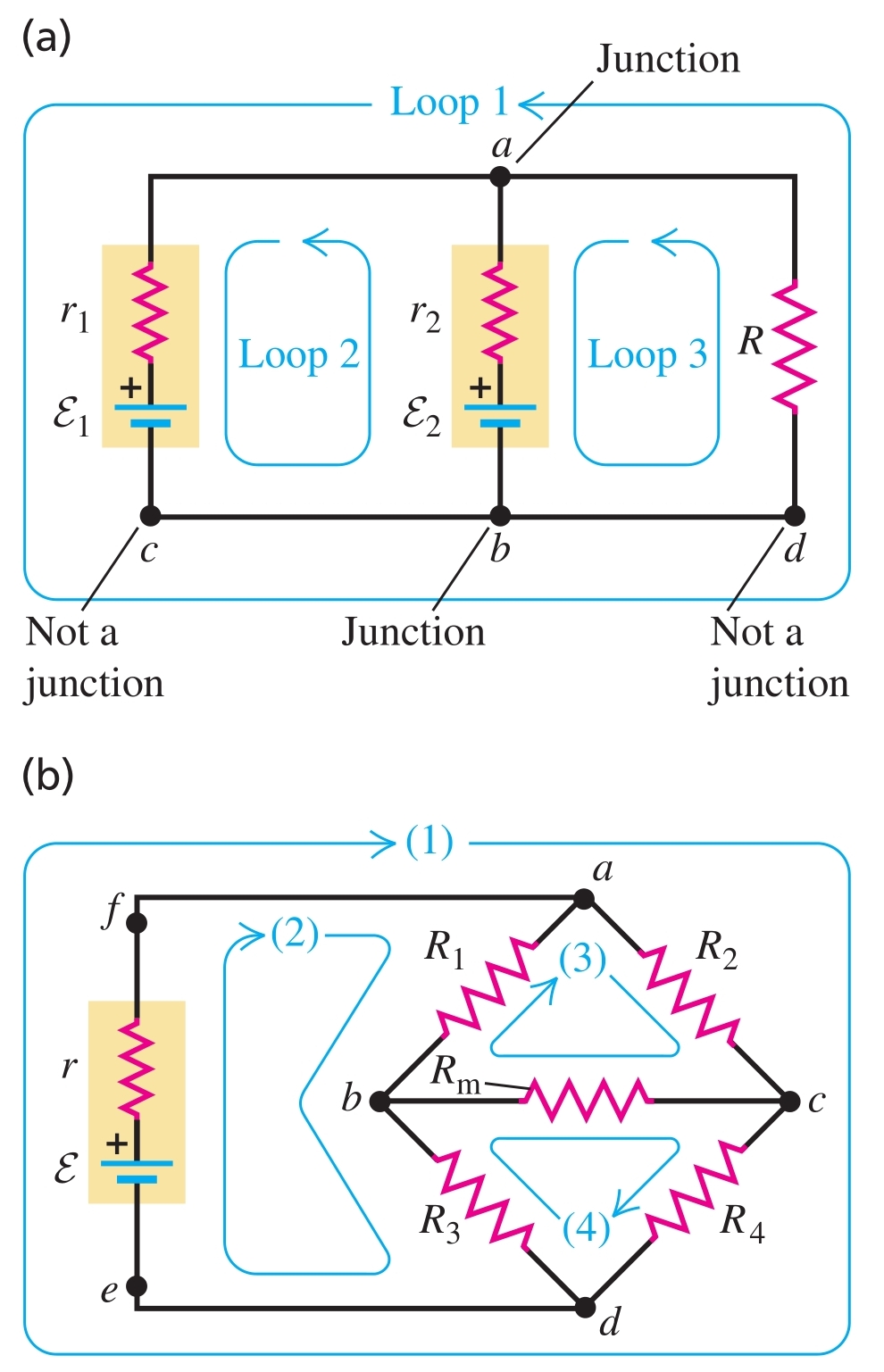
- цикъл - всяка пътека от веригата, която започва и завършва в една и съща точка
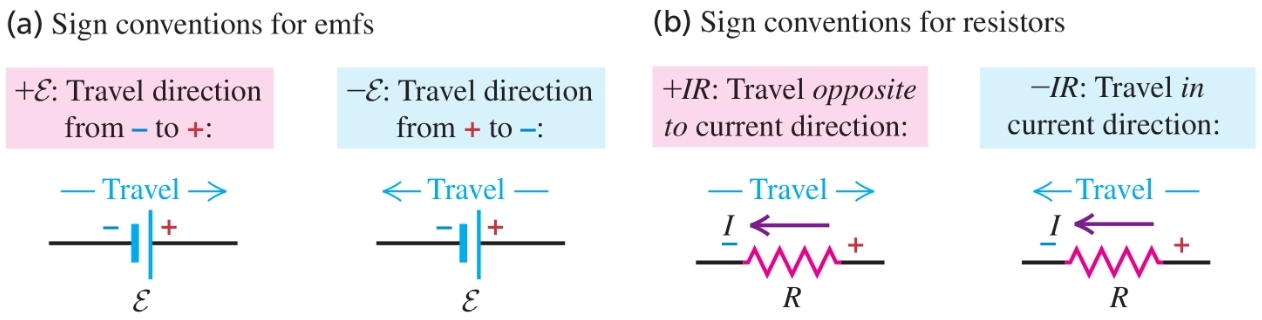
-
Кондензатор - система от две електропроводящи пластини, между които има диелектрик или вакуум
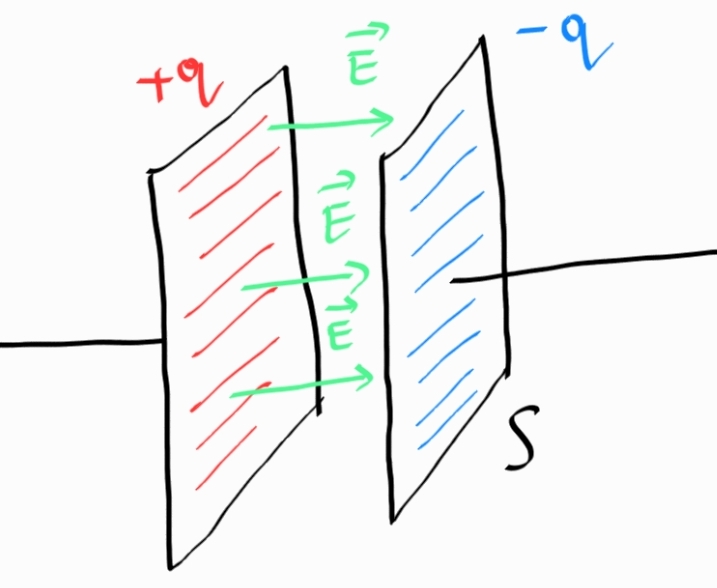
а) зареждане - при свързване на кондензатора към източник на напрежение, върху двете му пластини ще се индуцират заряди с еднаква големина, но различен знак
- електрично поле - между пластините на зареден кондензатор възниква еднородно електрично поле, което зависи от заряда на кондензатора , диелектричната проницаемост на средата между двете пластини и площта на пластините
- напрежение - между пластините на кондензатора възниква напрежение, което зависи от разстоянието между тях
б) разреждане - ако източникът на напрежение се премахне, кондензаторът бързо ще се разреди, защото зарядите по пластините му се отблъскват, като по този начин ще протече ток по веригата
-
Капацитет () - отношението между заряда на кондензатора и напрежението между пластините му
а) зависимост - капацитетът е характеристична константа на кондензатора, която зависи само от площта на пластините и разстоянието между тях
б) мерна единица - фарад
-
Потенциална енергия на кондензатор
-
Кондензатор в електрична верига - означава се с
а) последователно свързване - последователно свързаните кондензатори с капацитети са еквивалентни на един кондензатор с капацитет , за който важи
б) успоредно свързване - последователно свързаните кондензатори с капацитети са еквивалентни на един кондензатор с капацитет , за който важи
-
Магнетизъм - взаимодействие, което възниква между всеки два движещи се електрични заряда
-
Магнитно поле - всеки движещ се заряд създава магнитно поле, което въздейства върху всеки друг движещ се заряд
а) магнитна индукция () - физична величина, характеризираща големината и посоката на магнитното поле
- мерна единица - тесла
б) на точков заряд - отнася се за магнитното поле, което точков заряд , движещ се със скорост , създава в точка с радиус вектор спрямо заряда
- магнитна пермитивност на вакума ()
в) принцип на суперпозицията - магнитното поле в дадена точка е векторната сума на магнитните полета, които движещи се заряди създават в тази точка
-
Магнитна сила - въздейства върху всеки заряд , движещ се със скорост в магнитно поле с индукция
а) големина - зависи от ъгъла между вектора на скоростта и вектора на магнитната индукция
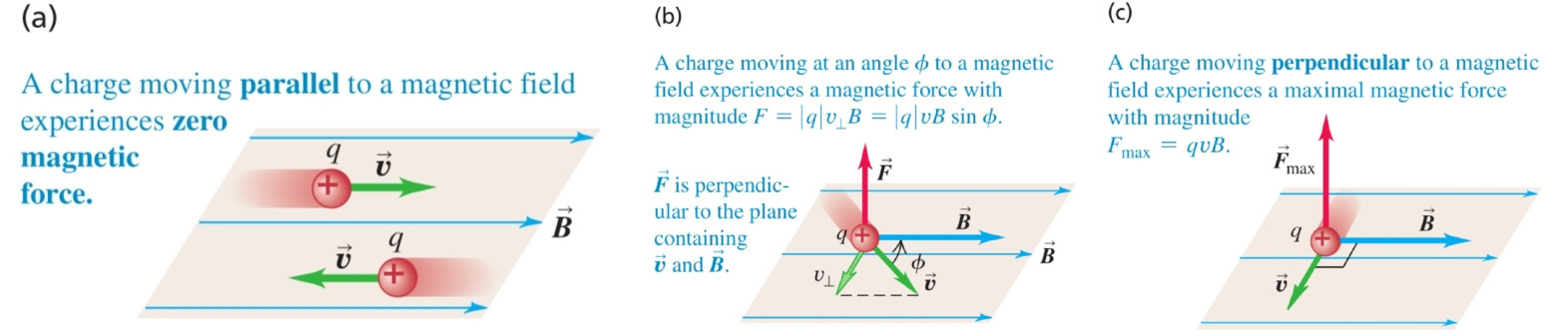
Магнитната сила променя само посоката на скоростта на заряда, но не и нейната големина.
б) посока - определя се от правилото на дясната ръка и винаги действа перпендикулярно и на скоростта на заряда, и на магнитната индукция
- за положителен заряд - когато палецът е по посока на скоростта на заряда, а останалите пръсти следват магнитната индукция, силата излиза от дланта и е перпендикулярна на нея
- за отрицателен заряд - когато палецът е по посока на скоростта на заряда, а останалите пръсти следват магнитната индукция, силата влиза в дланта и е перпендикулярна на нея
-
Магнитна сила върху прав проводник - отнася се за прав проводник с дължина , намиращ се в магнитно поле , по който тече ток
- векторът е насочен по посока на тока
-
Магнитно поле на проводници
а) закон на Био-Савар - за магнитното поле, което безкрайно малък проводник с дължина , по който тече ток , създава в точка с радиус вектор спрямо проводника
б) в центъра на пръстен - отнася се за проводник във форма на пръстен с радиус , по който тече ток
в) на безкрайно дълъг прав проводник - отнася се за магнитното поле на безкрайно дълъг проводник, по който тече ток , създава в точка на разстояние
-
Поток на магнитното поле
-
Променлив ток - ток, породен от източник на променливо напрежение
а) източник на променливо напрежение (алтернатор)
-
Синусоидно напрежение
а) характеристики
- амплитуда на напрежението () - определя максималното и минималното напрежение на източника
б) ефективно напрежение
-
Резистор при синусоидно напрежение
а) закон на Ом
б) ефективен ток
- връзка с ефективното напрежение
в) мощност
г) импеданс ()
-
Кондензатор при синусоиден ток
-
Точност, прецизност, грешка
а) измерване - сравняване с някакъв еталон
- точност на резултата - степента, до която измереният резултат се доближава до реалната стойност
- прецизност на измерването - степента, до която измерените резултати съвпадат едни с други
- грешка - разликата между реалната и измерената стойност; натрупва се винаги в последната цифра от резултата
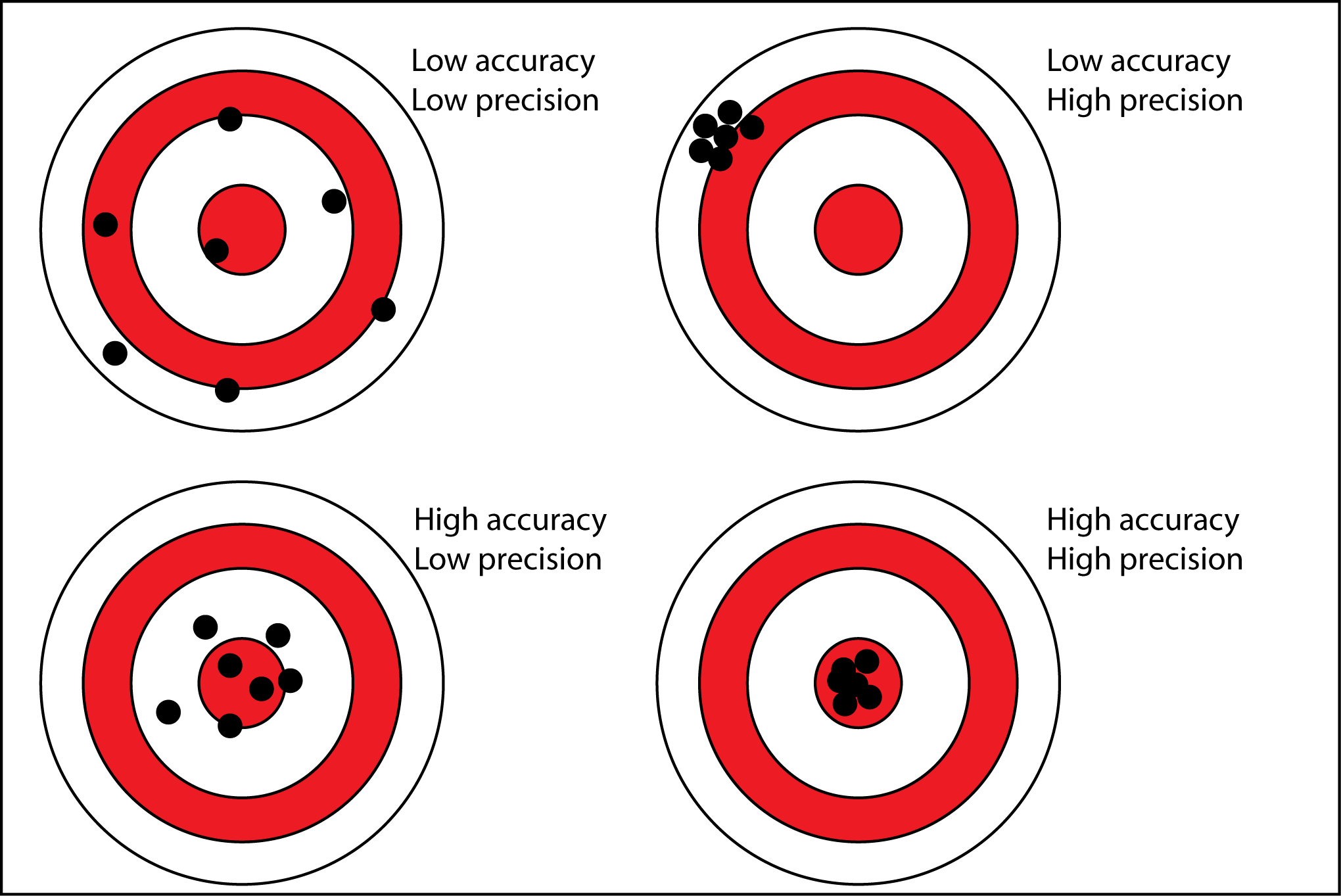
-
Значещи цифри - цифрите в мантисата на резултата, записан в научен запис
а) умножение и деление - резултатът се записва с толкова значещи цифри, колкото има най-неточният операнд
б) събиране и изваждане - резултатът има толкова цифри след десетичната запетая, колкото има операндът с най-малко цифри след запетаята
в) закръгляване - само накрая
При използване на повече от необходимото значещи цифри се трупа излишна грешка!
-
Дименсионен анализ - извършване на математически действия с мерни единици
-
Маса на атома
а) маса на съставящите го части
- маса на протона:
- маса на неутрона:
- маса на електрона:
б) маса на атома - сбор от масите на съставните му части, като електроните се пренебрегват поради незначителната си маса
- масово число:
- атомна единица за маса - Далтон
Атомната мерна единица често се изпуска и ако масата на атома е дадена в такива единици, тя съвпада с масовото число.
-
Маса на химичните елементи
а) химичен елемент - постоянната смес от всички изотопи на един и същ атом
- всеки елемент си има изотопи , като всеки съставля определен процент от всички атоми на този елемент
- процентно разпределение на изотопите:
Пример:
Хлорът се среща в два основни изотопа и със съответни процентни разпределния и .
б) относителната атомна маса ()- линейната комбинация от масите на всички изотопи на даден елемнт с коефициенти техните процентни разпределния
-
Маса на веществата
а) относителна молекулна маса - сборът от относителните атомни маси на атомите, образуващи дадено съединение
Пример:
-
Количество вещество () - величина, характеризираща броя частици в дадено вещество
а) константа на Авогадро
б) мерна единица - един мол е количеството вещество, при което относителната молекулна маса на веществото цифрено съвпада с реалната му маса
- в един мол вещество винаги има един и същ брой частици -
Пример:
Един мол въглерод има относителна атомна маса и реална маса .
-
Молна маса () - масата на 1 mol от дадено вещество
- характеристична величина за всяко вещество -> константа за едно и също вещество
- числено равна на относителната молекулна маса
-
Масова част на елемент в съединие () - частта от масата на съединението, която представлява масата на елемента
- постоянна и независеща от масата на съединението:
- число между нула и едно:
-
Емпирични и молекулни формули
а) емпирична формула - показва недействителен количествен състав на химичното съединение, като представя отношенията между броевете атоми в най-простия им вид
б) молекулна формула - показва действителния количествен състав на химичното съединение
в) връзка между молекулната и химичната формула - за едно и също съединение отношението на относителната молекулната маса, сметната по молекулната формула, към относителната молекулна маса, сметната по емпиричната формула, е винаги цяло число
Пример:
Молекулна формула на бензена:
Емпирична формула на бензена:
-
Молни отношения по химична формула
-
Химично уравнение - символен запис на химична реакция
-
Молни отношения по химично уравнение
-
Добив
а) същност - в практиката химичните реакции протичат неперфектно, следователно винаги се получава по-малко количество продукт от теоретично изчисленето
б) добив () - съотношението между теоретично изчислената и реалната експериментална стойност на дадена величина
в) лимитиращ реагент - изходният продукт, чието количество вещество е най-малко и след чието изчерпване реакцията спира
- определяне на лимитиращ реагент - лимитиращ реагент е изходното вещество, за което количеството вещество разделено на коефициента пред него има най-ниска стойност
Пример:
- молни отношения винаги се съставят спрямо лимитиращият реагент
-
Обща характеристика на газовете
- значителни разстояния между частиците
- изключително слаби междумолекулни взаимодействия
- винаги образуват хомогенна смес при смесване
- нямат собствени форма и обем
-
Налягане () - сила, действаща върху единица площ
а) мерни единици
- паскал:
- бар:
б) атмосферно налягане
-
Идеален газ - теоретична абстракция, абстрахираща са от индивидуалните характеристики на частиците на газа, като ги разглежда като материални точки
а) закон на Бойл - при константнти
б) закон на Шарл - при константни
в) закон на Гей-Люсак - при константнти
г) закон на Авогадро - при
- в следствие на закона на Авогадро, равен брой частици от различни газове имат винаги един и същ обем при еднакви условия
- молен обем () - обемът, който един мол от произволен газ заема при дадени условия
-
Стандартни условия - за изчисления, свързани с газове, последните трябва да са поставени при еднакви условия
а) стара дефиниция
б) нова дефиниция
-
Уравнение на Менделеев-Клайперон - обединение на четирите газови закона в уравнение на състоянието на идеален газ
- универсална газова константа:
-
Молна част ( ) - отношението между броя молове на дадено вещество и общия брой молове в системата
-
Парциално налягане - налягането, което даден газ упражнява, когато е изолиран в даден обем
-
Закон на Далтон - при постоянни температура и обем, налягането в сместа от газовете е сборът от парциалните им налягания за същия обем
а) връзка между парциалното налягане и молната част на дадено вещество
Доказателство:
-
Моларност () - молна концентрацията на разтвореното вещество в разтвора
а) мерна единица - моларност ()
-
Молалност - молалната конентрация на разтвореното вещество в разтвора
а) мерна единица - молалност ()
б) особености
- не зависи от температурата
-
Масова част на разтвореното вещество в разтвора
а) единици
- проценти (%) -
- parts per million (ppm) -
- parts per billion (ppb) -
-
Закони за смесването и разреждането
а) закон за смесването - при смесването на два разтвора с маси и масови части на разтвореното вещество съответно и се получава нов разтвор с маса и масова част
б) закон за разреждането - разреждането е просто смесваме с чист разтворител, т.е. с разтвор с нулева масова част на разтвореното вещество
-
Титруване - експериментален метод за определяне на концентрацията на компонентите в даден разтвор
а) процес
- в бюретата се сипва разтвор с известна молна концентрация
- в Ерлен-Майеровата колба се сипва разтвор с неизвестна коненцентрация, но известен обем
- в Ерлен-Майеровата колба се добавя и индикатор
- чрез кранчето на бюретата започва бавно да се капе от разтвор в разтвор до пълно протичане на реакцията
- когато индикаторът се измени напълно, реакцията е приключила и капенето се спира
- отчита се промяната в обема на разтвора в бюретата, съставя се молно отношение по химичното уравнение на реакцията и се изчислява концентрацията на
-
Характеристика на атомното ядро
а) съставни части - нуклеони
- протони ()
- неутрони ()
б) масово число
- - атомен номер
- - брой неутрони
в) маса -
г) размер
д) плътност
-
Нуклиди
а) същност - материя, създадена от нуклеони
б) означение -
в) видове
наименование брой брой масово число () химични свойства примери изотопи еднакъв различен различно еднакви изобари различен различен еднакво различно изотони различен еднакъв различно различни -
Естествена радиоактивност - самоволното и спонтанно разпадане на атомните ядра на някои елементи
а) видове ядрени реакции
вид природа общо уравнение промяна в атомния номер () промяна в масовото число() -разпад ядра -2 -4 -разпад поток от +1 0 -разпад поток от -1 0 -лъчение поток от фотони -лъчи 0 0 улавяне на поглъщане на вътрешен от ядрото
-1 0 б) стабилност на нуклидите - критерий за стабилност е съотношението между броя неутрони и броя протони в ядрото
- - стабилни при
- - стабилни при
- - нестабилни
в) период на полуразпад () - времето, за което количеството на даден радиоактивен изтопо намалява наполовина
-
Изкуствена радиоктивност - изкуствено предизвикан ядрен разпад на изотоп при облъчването му с поток от или ядра
а) история - открита през 1934г. от Фредерик и Ирен Жольо-Кюри
б) приложения
- синтез на трансуранови () и свръхтежки () елементи, чийто период на полуразпад е от порядъка на
- ядрени електроцентрали
- ядрени оръжия
-
Ядрена химия на урана (или как да си направим атомна бомба)
а) изотопи на природния уран - уран-238 () и уран-235 ()
- обогатяване на урановата руда - процес на увеличаването процентното съдържание на уран-235 в рудата, защото този е изотопът, който участва в ядрени реакции
б) изкуствен разпад
- критична маса - при повече от 20кг обогатен уран (15-20% ) реакцията се самоподдържа и става верижна
- контролирано делене - в АЕЦ
- неконтролирано делене - в атомните бомби; две маси са разделени от преграда и при детониране преграда се премахва а двете маси се сливат така, че и верижната реакция започва
-
Ядрен синтез (или как се прави водородна бомба) - от сливането на ядра на елементи с по-ниска маса се синтезират ядра на по-тежки елементи, при което се отделя колосално количество енергия
а) механизъм на водорните бомби
- при синтеза на 1 грам хелий се отделят MeV
- липсва критична маса
б) устройство на водородната бомба

- запалка - атомна бомба, която служи за покачване на температурата
- гориво - литиев деутерид, който е източникът на деутерий и тритий
-
Масов дефект () - при ядрените реакции се отделя огромно колочество енергия , затова масата на продуктите е по-малка от масата на реагентите
- определя се по уравнението на Айнщайн
-
Модел на Ръдърфорд (планетарен модел) - приема електроните за малки частици, които обикалят около ядрото по кръгови орбити
а) недостатъци
- не обяснява стабилността на атома - според този модел електроните трябва да се разбият в ядрото
- не обяснява прекъснатия излъчвателен спектър на атомите
-
Модел на Бор - обединява модела на Ръдърфорд с квантовата теория на Макс Планк
а) квантуване на енергията - енергията се предава на порции, наречени кванти, и затова може да има само точно определени разрешени стойности
- - константа на Планк
б) постулати на Бор
- електроните се движат по стационарни кръгови орбити, без да излъчват енергия
- енергия се излъчва само когато електроните падат от по-високо енергийно ниво на по-ниско
Всеки такъв преход съответства на една спектрална линия в излъчвателния спектър на атома.
в) недостатъци
- описва само водородния атом
- работи с постулата
- приема електроните за частици
- теорията се наглася спрямо конкретни емпирични данни, вместо да ги предсказва правилно
- не обяснява химичните връзки
-
Квантови числа - всеки електрон в електронната обвивка може да са характеризира от четири числа
а) главно кватново число () - показва електронния слой, в който се намира електронът
- приема положителни целочислени стойности -
- колкото по-високо е главното квантово число, толкова по-висока енергия имат електроните в съответстващия слой
Слой K L M N O P б) орбитално квантово число () - показва подслоя, в който се намира електронът
- всеки слой е разделен на подслоеве, всички от които имат близка до тази на слоя енергия
- слой с главно квантово число се разделя на различни подслоя - първият слой се разделя на един подслой, вторият слой се разделя на два подслоя, третият на три и т.н.
- орбиталното квантово писло показва номера на подслоя, започвайки от нулата -
подслой означение s p d f g 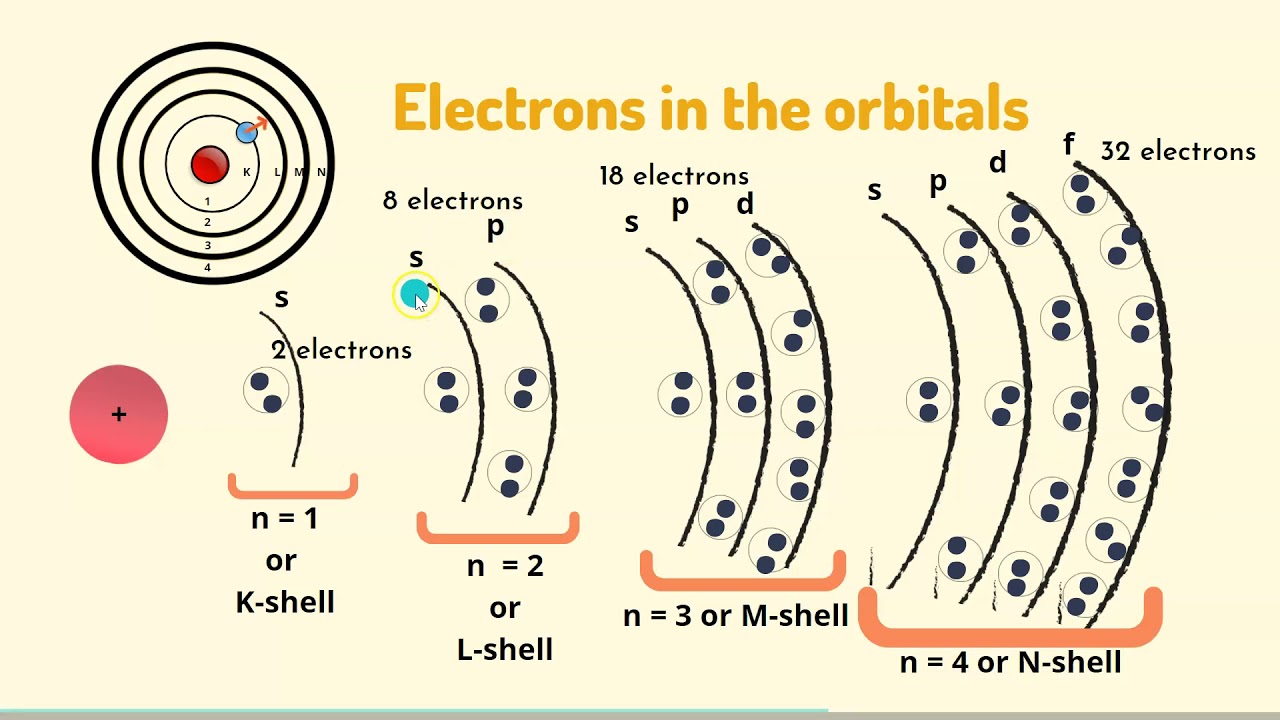
Пример: Електрон, който се намира в третият подслой () в слоя се означава с , а електрон, който се намира във втория подслой на слоя ще се означи с .
в) магнитно орбитално квантово число () - характеризира взаимодействието на магнитното поле, създадено от движението на електрона при поставянето на атома във външно магнитно поле
г) магнитно спиново квантово число () - характеризира собствения магнитен момент на електрона
-
Корпускулно-вълнови дуализъм - обектите в микросвета се описват от вълнови функции, което един път им придава свойства на частици, а друг път - на вълни
а) вълна на Дьо Бройл - всеки обект се характеризира от вълна с дължина, зависеща от неговите маса и скорост
б) принцип на неопределеността на Хайзенберг - не е възможно точното определяне на местоположението и скоростта на даден микрообект в един и същ момент
- произведението в грешките между импулса и позицията винаги е по-голямо от
- редуцирана константа на Планк:
-
Вълнова функция - всеки микрообект се описва от функция от вида
а) уравнение на Шрьодингер - описва еволюцията на вълновите функции
- решенията на уравнението се наричат вълновни функции
- аналитични решения на уравнението съществуват само за прости системи като единични електрони
- в останалите случаи се използват числени методи за решаване
б) статистическа интерпретация на Борн - квадратът на абсолютната стойност на вълновата финкция дава вероятността обектът, който описва функцията, да се намира на мястото с координати
-
Атомни орбитали - вълнови функции, които описват единични електрони в потенциала, създаден от атомното ядро
а) обозначение - вълновата функция описва електрон с квантови числа
- показва размера на орбиталата - колкото по-високо е , толкова по-голяма енергия има електрона и толкова по-голяма е орбиталата
- показва формата на орбиталата - орбитали с различно и еднакво имат еднаква форма, но различен размер
- характеризира пространствената ориентация на обриталата
б) видове - орбиталите с едно и също се групират заедно, показвайки подслоя, който описват
- -орбитала - описва електрон в подслой
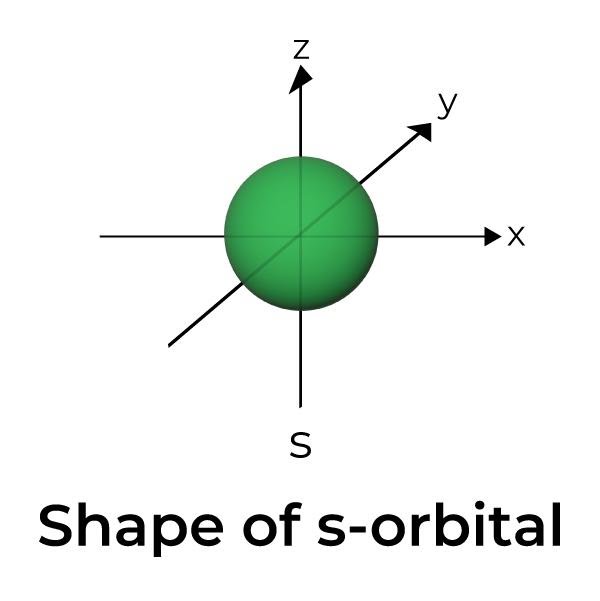
- -орбитали (3 вида) - описват електрони в подслой
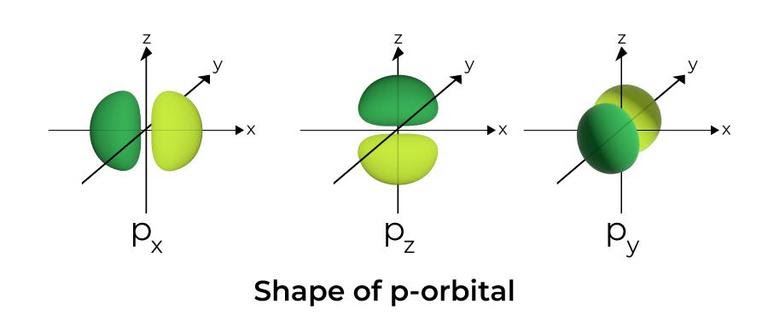
- -обритали (5 вида) - описват електрони в подслой
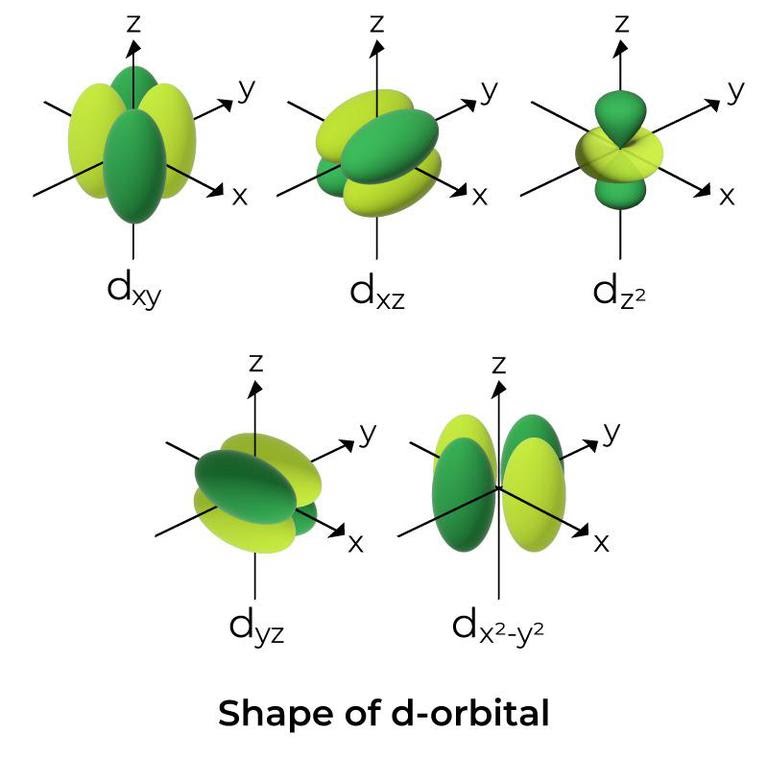
- -орбитали (7 вида) - описват електрони в подслой
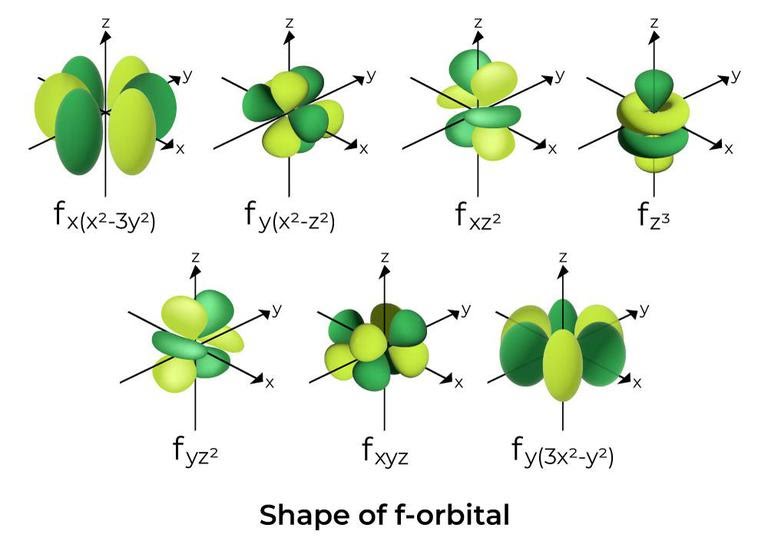
в) квантова клетка - всяка орбитала представлява квантова клетка, която може да съдържа най-много 2 електрона и то само ако спиновете им са противоположни
г) изродени орбитали - орбитали с еднаква енергия (еднакви и )
- имат еднакъв размер и форма, но различна пространствена ориентация
-
Принцип на Паули - в електронната обвивка на даден атом не може има два електрона с 4 еднакви квантови числа
- всяка орбитала може да съдържа максимум 2 електрона и то само ако са с противоположни спинове
-
Принцип на изграждането - състоянията се запълват с електрони по възходящ ред на тяхната енергия
а) правило на Маделунг - Клечковски - качествена оценка на енергията на дадено състояние
- при еднаква енергия на състоянието () за по-енергитично се смята състоянието с по-голямо
Пример:
Състояние Ред на запълване 3 1 4 първо 3 2 5 трето 4 0 4 второ -
Правило на Хунд - изродените състояния се запълват с електрони, така че сумата от магнитните им спинови числа да е максимална
- изродените състояние се запълват първо изцяло с единични електрони и чак след това те започват да се сдвояват
Пример: Разпределнието на 4 електрона в послой е следното
||||||
Защото , което е по-голямо от при следната подредба със :
||||||
а) магически числа - следните изродени състояния са особено стабилно, ако са изцяло заето с единични електрони или електронни двойки:
- ако на подслоя на даден слой не му достига 1 електрон, за да бъде в едно от тези състояния, то 1 електрон ще падне от горния слой в този, за да е по-стабилно състоянието
Пример:
Хромът би трябвало да има 4 електрона в и 2 електрона в , но единият от електроните в пада в , за да се получи .
-
Електронна конфигурация - показва разпределението на електрони по слоеве и подслоеве в даден атом
а) електронна формула - изписват се подслоевете във всеки слой, като броя електрони в тях се записва като степен
Пример: въглерод -
- за по-кратко запълнените електронни слоеве се заместват от наименованието на последния инертен газ, който също има тези слоеве запълнени
Пример: хлор -
б) енергетична диаграма - изобразяват се квантовите клетки на всяко изродено състояние, вътре се изобразяват спиновете на електроните, а самите изродени състояния се подреждат по енергия
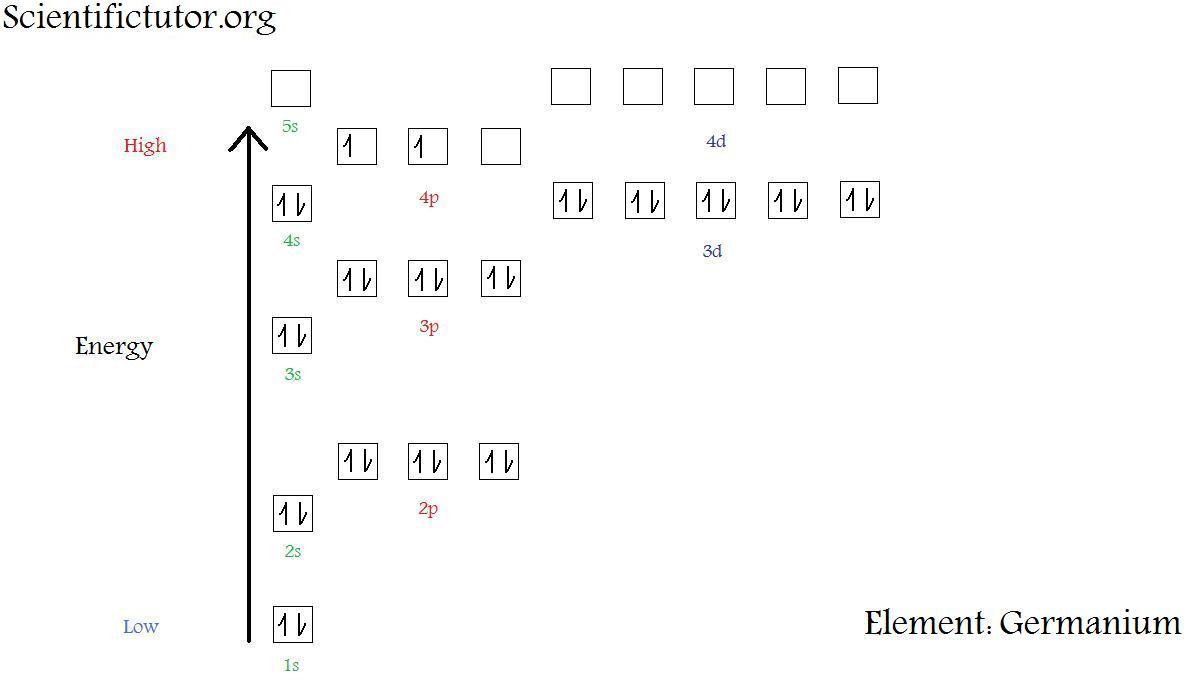
в) възбудено състояние - при поглъщане на енергия електрон в атома може да прескочи от по-ниско енергиен подслой в по-високо енергиен подслой
- възбуждането при химичните реакьии винаги се осъществява в рамките на един и същ слой, защото няма достатъчно енергия за прескачането на цели слоеве
-
Атомен радиус () - разстоянието между ядрото и външния електронен слой на атома
а) мерни единици
- нанометър:
- пикометър:
- ангстрьом:
б) измерване - половината от дължината на връзката в хомоядрената молекула на атома
в) тенденции в изменението - в периодичната таблица
- нараства от горе надолу
- намалява от ляво надясно
-
Йонен радиус
а) радиус на катион () - винаги по-малък от атомния радиус на съответния атом, защото липсват електрони от външния слой
б) радиус на анион () - винаги по-голям от атомния радиус на съответния атом, защото външния слой съдържа повече електрони
-
Йонизационна енергия () - енергията, нужна за отделянето на 1 електрон от неутрален атом или йон
а) йонизационни степени - в зависимост от колко електрона вече са отделени, йонизационната енергия, нужна за отделянето на още едим електрон, се променя
- първа - енегията, нужна за отделянето на 1 електрон електрон от неутрален атом в газова фаза
- по-високи йонизационни степени - енергиите нужни за отделяне на електрон от йон с даден заряд
б) тенденции в измяната
- първа йонизационна енергия - в периодичната таблица от горе надолу намалява, а от ляво надясно расте
- йонизационните енергии на даден елемент нарастват с броя електрони
- йонизационната енергия за йон, който е в едно от устойчивите състояния според магическите числа, е в пъти по-голяма от другите му йонизационни енергии, защото не той не иска да напусне стабилното състояние
в) мерни единици -
-
Електроафинитет ()- енергията, която съпътства приемането на 1 електрон от неутрален атом в газова фаза
а) знак
- - процесът е ендотермичен и атомът не обича да приема електрони
- - процесът е екзотермичен и атомът обича да приема електрони
б) тренденции в изменението
- от ляво надясно расте
- от горе надолу намалява
- елементи, които биха били изведени от устойчиво състояние чрез приемането на електрон, не образуват аниони
-
Съвременна периодична таблоца - дългопериодна (след 1988г.)
а) блокове - разделяне на елементите според това кой подслой изграждат
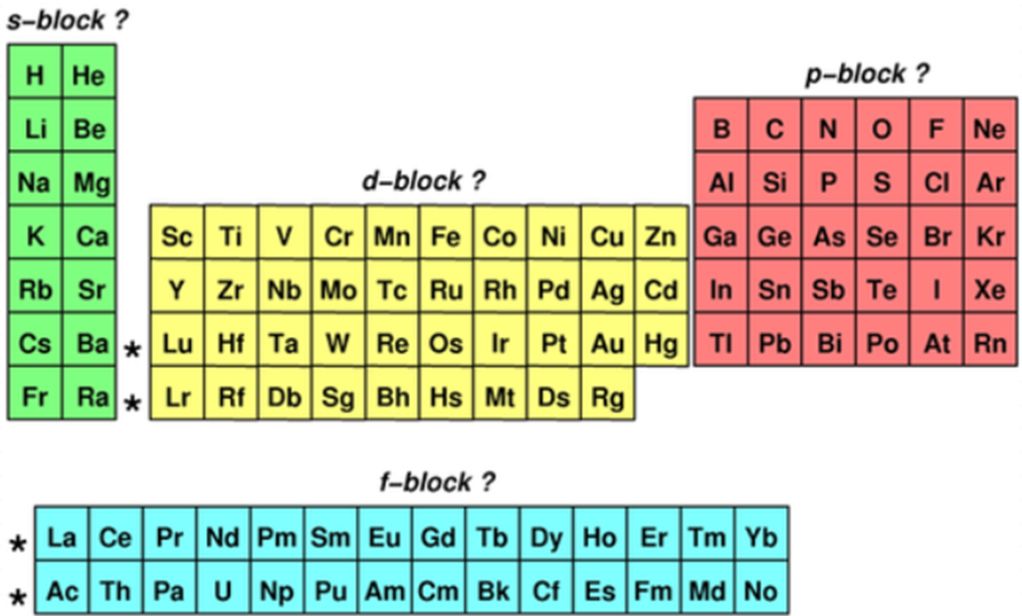
- -блок () - елементите в него изграждат подслоя на външния си електронен слой
- -блок () - елемнтите в него изграждат подслоя на външния си електронен слой
- -блок () - елементите в него изграждат подслоя на предпоследния си електронен слой
- -блок () - елементите в него изграждат подслоя на предпредпоследния си електронен слой
б) групи - колони от химични елементи, имаши еднакво разпределение на електроните във валентния си електронен слой
- 1 (IA):
- 2 (IIA):
- 3 (IIIБ):
- 4 (IVБ):
- 5 (VБ):
- 6 (VIБ):
- 7 (VIIБ):
- 8 (VIIIБ):
- 9 (VIIIБ):
- 10 (VIIIБ):
- 11 (IБ):
- 12 (IIБ):
- 13 (IIIA):
- 14 (IVA):
- 15 (VA):
- 16 (VIA):
- 17 (VIIA):
- 18 ( IIIA):
-
Електронни аналози
-
Йонна химична връзка - посредством пренос на електрони между атомите се образуват йони, между които възникват електростатични сили на привличане и това води до подреждането им в кристална решетка
а) октетно правило - при образуване на йонни химични връзки атомите на елементите от А групите се стремят да получат външен елвктронен слой, който съдържа 8 електрона в 4 електронни двойки
Пример:
-
Цикъл на Хабер-Борн - механизъм на образуване на йонните химични връзки
a) атомизация - реагентите се превръщат в газове (ако вече не са такива)
- сублимация на натрия
- хлорът е газ - остава непроменен
б) дисоциация - разпадане на веществата на атоми
в) йонизация - образуване на йони
- образуване на катиони
- образуване на аниони
г) кристализация - образуване на кристалната решетка
- Кулонова стабилизация () - енергията, която се отделя при образуването на йонния кристал
-
Енергия на кристалната решетка - енергията, нужна, за да се разруши 1 мол кристална решетка до изграждащите я йони в газообразно състояние
- - константа на Кулон
- - заряди на йоните
- - дължина на йонната връзка в атомната решетка
-
Ковалентна връзка - вид химична връзка, при която електрони се споделят между атомите и се образуват общи електронни двойки
а) обменен механизъм - двата атома имат равностойно участие в образуването на електронната двойка
б) донорно-акцепторен механизъм - единият атом вече има готова електронна двойка и позволява на другия да я използва
-
Порядък (кратност) - броят общи електронни двойки споделени между двата атома
а) прости връзки - 1 споделена електронна двойка
б) сложни връзки - 2 или 3 споделени електронни двойки
-
Полярност - разпределението на заряда по молекулата
а) електроотрицателност () - свойството на даден атом да изтегля общата електронна двойка към себе си
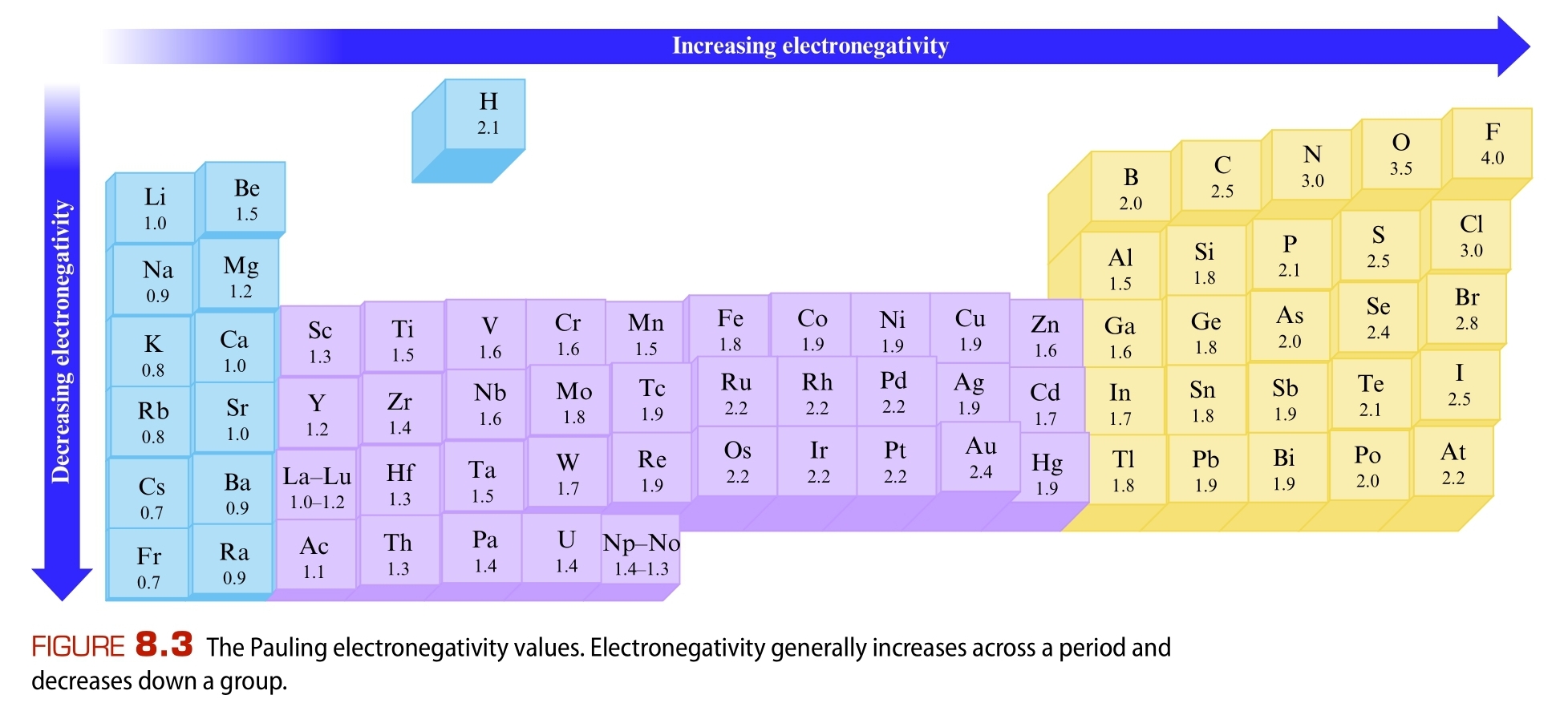
- надясно расте
- надолу намалява
- колкото по-висока е електроотрицателността на даден атом, толкова повече той изтегля към себе си споделената електронна двойка
б) видове връзки според полярността - колкото по-голяма е разликата в електроотрицателностите на атомите във връзката, толкова по-полярна е тв
- неполярни - електронната двойка е еднакво привлечена към двата атома, защото са от един и същ елемент
- полярни - електронната двойка е изтеглена повече към един от атомите, при което се образуват частични заряди и
-
Характеристики на ковалентните химични връзки
а) дължина () - разстоянието между ядрата на свързаните атоми
- при хомоядрени молекули:
- при хетероядрени молекули:
- обратнопропорционална на порядъка на връзката
б) здравина () - енергията, нужна за разпадането на дадена ковалентна връзка в 1 мол вещество
- обратно пропорционална на дължината на връзката - дългите връзки са по-чупливи
- правопропорционална на порядъка - повече споделени електронни двойки означават по-здрава връзла
- правопропорционална на полярността на връзката
-
Модел на връзката с локализирани електрони - молекулата е съставена от атоми, които споделят електронни двойки чрез орбиталите си, като всяка електронна двойка се счита като конкретно локализирана в пространството между атомите
-
Люисови формули - начин на изобразяване на валентните електрони на елементите и техните съединения
-
Люисови формули на елементите - първо се изобразяват единичните електрони по четирите страни на символа за химичния елемент чак след което те започват да се сдвояват

-
Люисови формули на съединения - споделените електронни двойки се изписват с една черта между двата атома, които свързват
а) съставяне
- преброява се общият брой валентни електрони в съединението
- избиране на централен атом - атомът, който присъства най-малко пъти в съединението и който може да съставя най-много връзки (обикновено е с най-ниска електроотроцателност)
- всички нецентрални атоми се свързват с по една проста връзка с централния - ако има два централни атома (атоми на един и същ елемент), те също се свързват помежду си с една проста връзка
- останалите електрони се разпределят по нецентралните атоми, така че те да имат стабилна конфигурация
- ако след това също останат електрони, те се записват при централния атом (или се разпределят между централните атоми, ако има повече от един)
- ако някой атом все още не е в стабилно състояние, той ще образува сложна връзка с някой от съседните си, за да се доближи до стабилно състояние
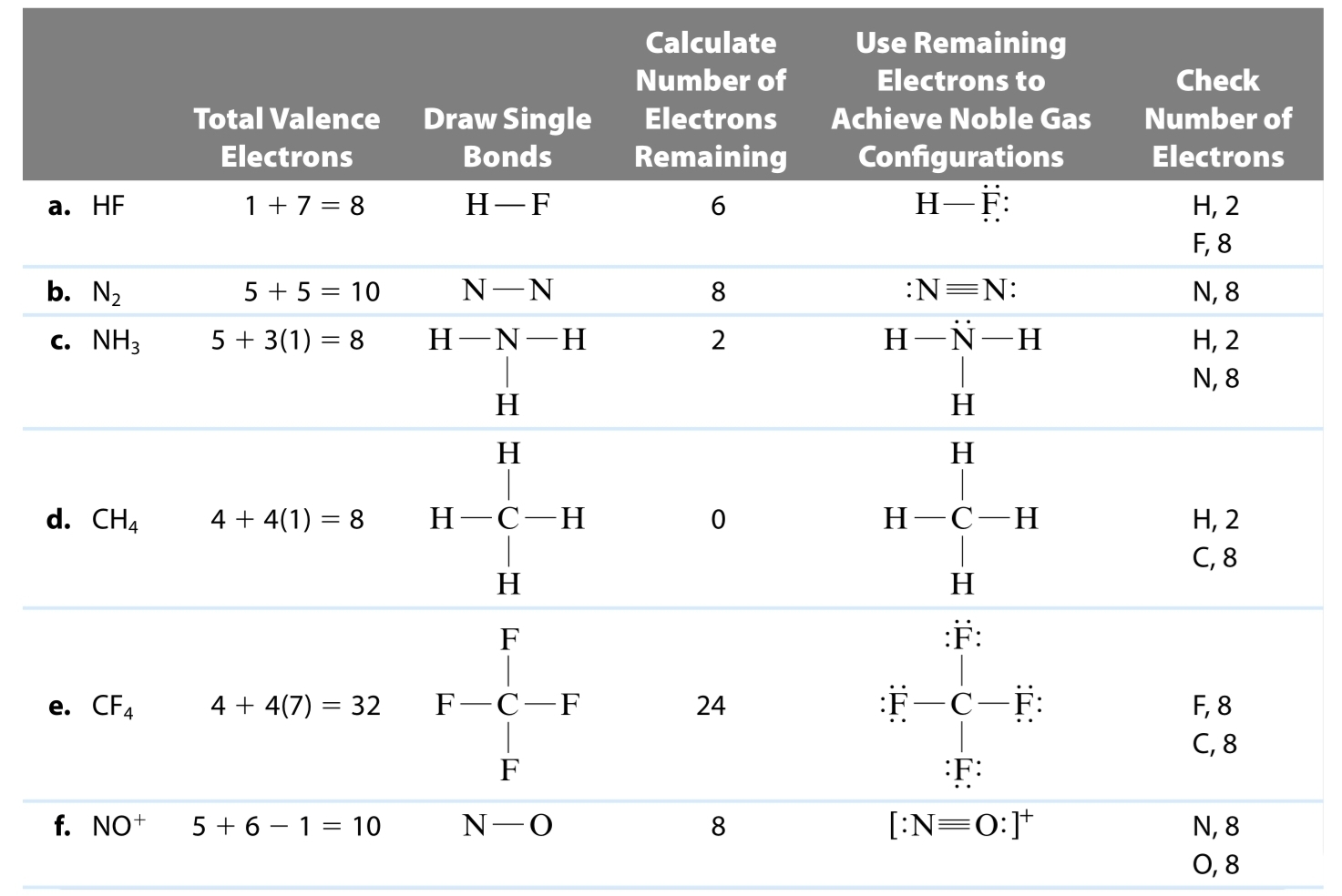
б) стабилни конфигурации
- повечето елементи се стремят към конфигурациите на благородните газове
- водородът е стабилен с 2 валентни електрона
- берилият е стабилен с 4 валентни електрона
- елементите от 13 (IIIA) група са стабилини с 6 валентни електрона
- елементите C, N, O, F винаги са стабилни с 8 валентни електрона
- някой елементи от 3 период надолу са стабилни с повече от 8 електрона, защото могат да държат електрони в орбиталите си
-
Теория на резонанса - понякога повече от една валидна Люисова формула съответства на едно и също съединение
а) резонансни структури - структурите, които остават възможни след написването на Люисовата формула за дадено съединение
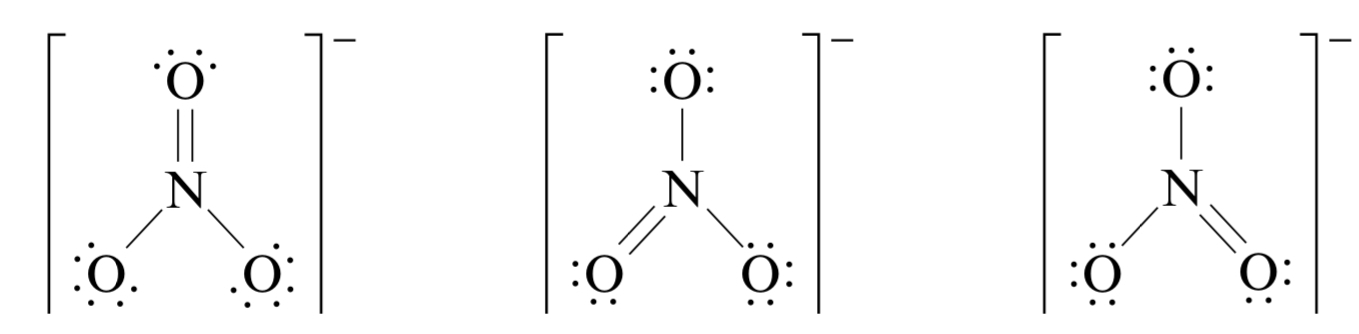
б) резонансен хибрид - реалното съединение е суперпозицията на резонансните си структури
- връзките, които присъстват във всичките резонансни структури се записват с непрекъснати линии
- връзките, които присъстват само в определени резонансни структури се записват с пунктирани линии
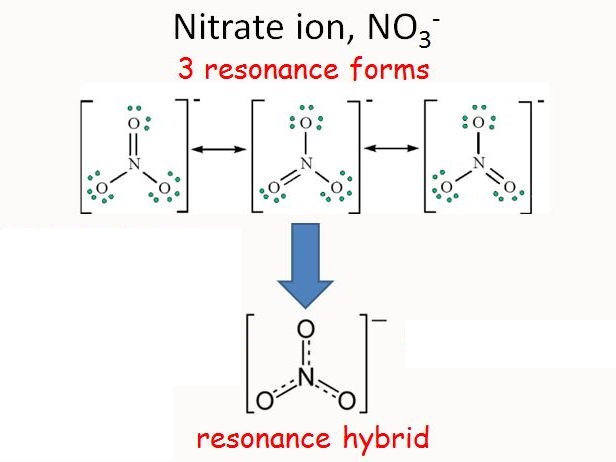
-
Формален заряд - критерии за преценка на това коя от резонансните структури най се доближава до истинския строеж на съединението
а) изчисляване
- споделените електронни двойки се смятат за по равно разпределени между споделящите ги атоми
б) сравняване на резонансните структури - резонансните структури, които най-много се доближават до реалната структура имат:
- атоми, чийто формален заряд е най-близо до 0
- атоми с висока електроотрицателност, чийто формален заряд е отрицателен
-
Геометрия на молекулите - молекулите имат триизмерна структура
а) перспективни (клиновидни) връзки - изобразяването на триизмерната структура на молекулите става от перспективата на равнина, в която се намират централният атом и възможно най-голям брой други атоми (освен когато по традиция има изключения)
- нормални връзки - свързват атомите в разглежданата равнина
- клиновидни предни връзки - свързват атом от равнината с атом пред нея
- прекъснати триъгълни връзки - свързват атом от равнината с атом зад нея
б) валентент ъгъл - ъгълът мржду някои два атома в молекулата
-
Метод на максималното отблъскване (VSEPR) - около всеки атом е дадена молекула са разположени отрицателно заредени облаци, които са максимално далеч един от дуг
а) отрицателно зареден облак - за 1 облак се считат:
- единичен електрон
- несподелена електронна двойка
- проста връзка
- двойна връзка
- тройна връзка
-
Предсказване геометрията на молекулите - зависи от броя заредени електронни облаци около централния атом в молекулата
Брой заредениноблаци Базова геометрия 1 неподелена двойка 2 неподелени двойки 3 неподелени двойки Валентни ъгли Примери 2 
 линейна
линейна180° 3 
 триъгълно-равнинна
триъгълно-равнинна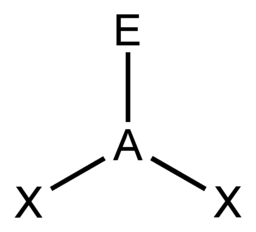
 огъната
огъната120° 4 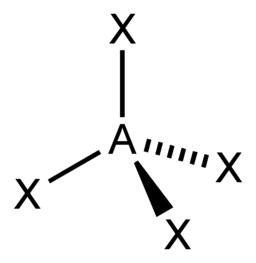
 тетраедрична
тетраедрична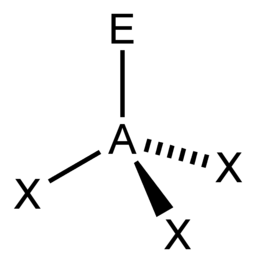
 триъгълнопирамидална
триъгълнопирамидална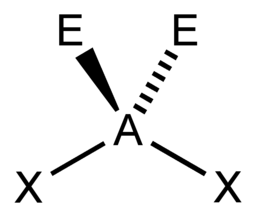
 огъната
огъната109°28' 5 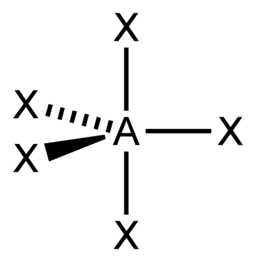
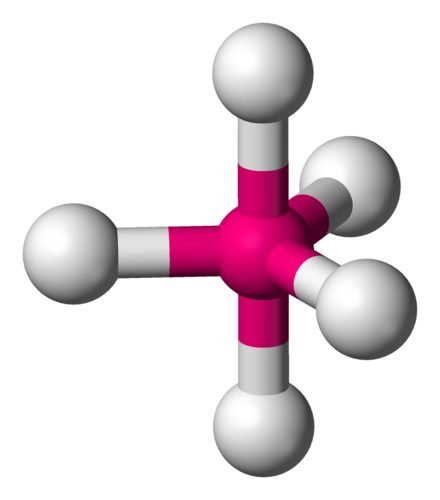 триъгълнобипирамидална
триъгълнобипирамидална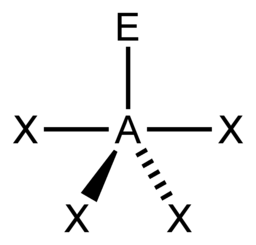
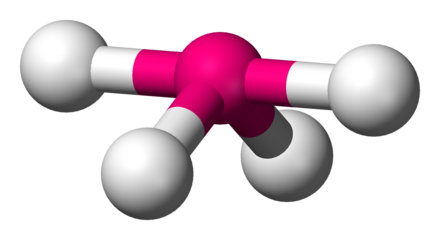 люлка
люлка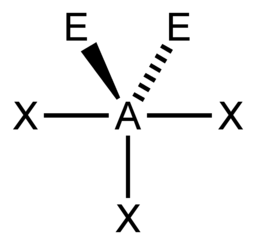
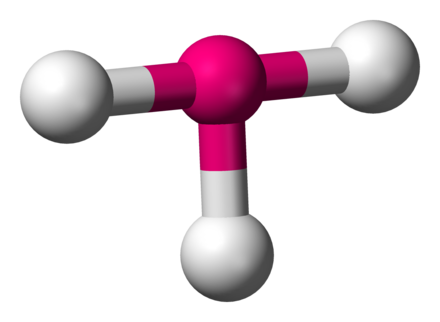 Т-образна
Т-образна
 линейна
линейнааксиален-аксиален: 180° аксиален-екваториален: 90° екваториален-екваториален: 120° 6 
 октаедрична
октаедрична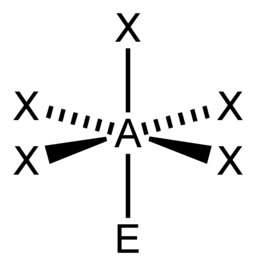
 квадратнопирамидална
квадратнопирамидална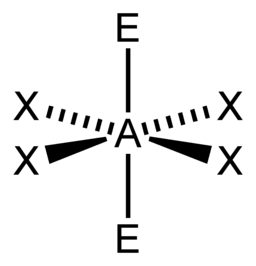
 квадратноравнинна
квадратноравнинна90°
-
Образуване на ковалентна връзка - ковалентна връзка се образува, когато атомни орбитали на два различни атома се припоприят в пространството
-
Сигма-връзка - припокриването става челно, т.е. по мислената линия, свързваща ядрата на двата атома
Всяка проста връзка е -връзка.
-
Пи-връзка - припокриването става около мислената линия, свързващата атомните ядра
-връзки могат да се образуват само след като вече има изградена връзка.
-
Хибридизация - процес на взаимодействие между валентните орбитали на един и същ атом, при който се образуват нови хибридни орбитали
-
Тетрагонална () хибридизация - при взаимодействието на едната орбитала с трите орбитали се получават четири хибридни орбитали
а) възникване - когато атомът в съединението участва в четири еднакви връзки
Пример:
-
Тригонална () хибридизация - при взаимодействието на орбиталата с две от орбиталите се получават три хибридни орбитали
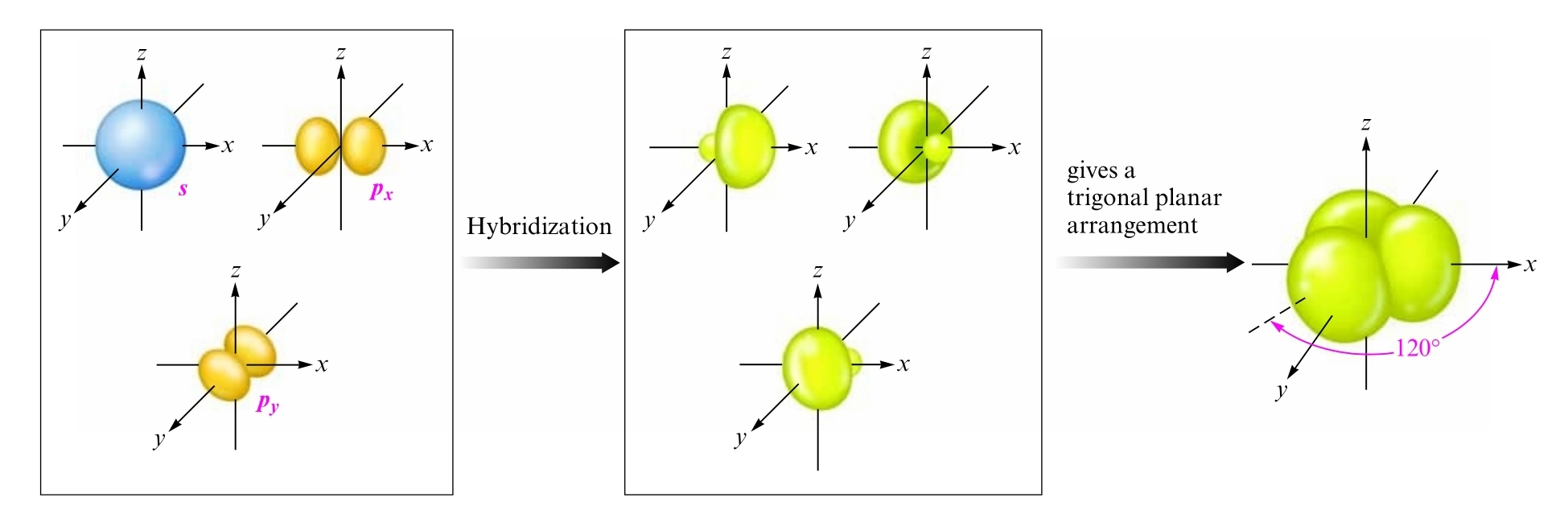
б) възникване - когато атомът в съединението участва в три еднакви връзки
Пример:
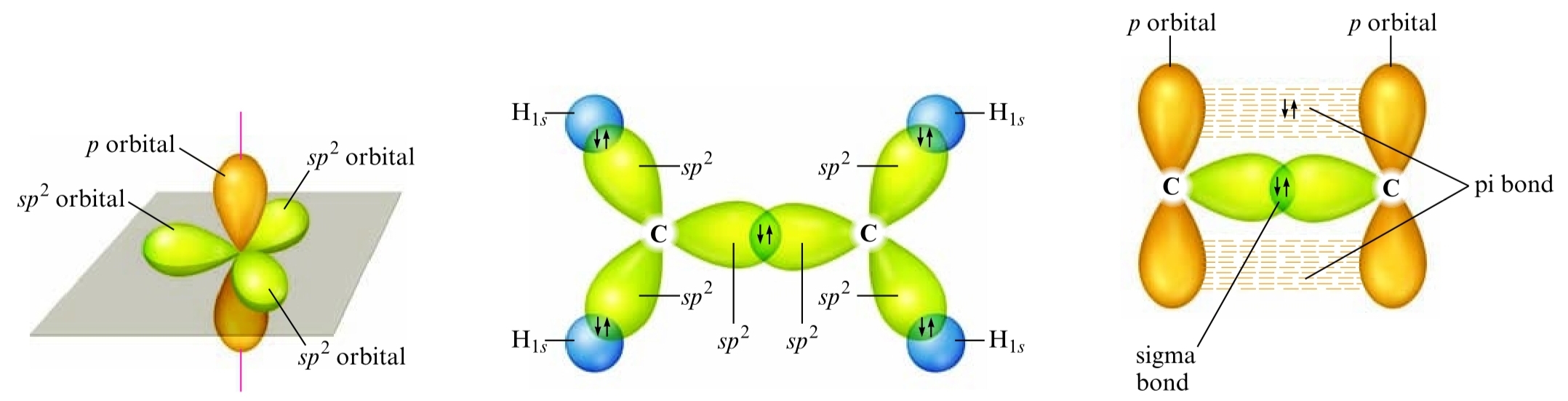
-
Дигонална () хибридизация - при взаимодействието на орбиталата с една орбитала се получават две хибридни орбитали
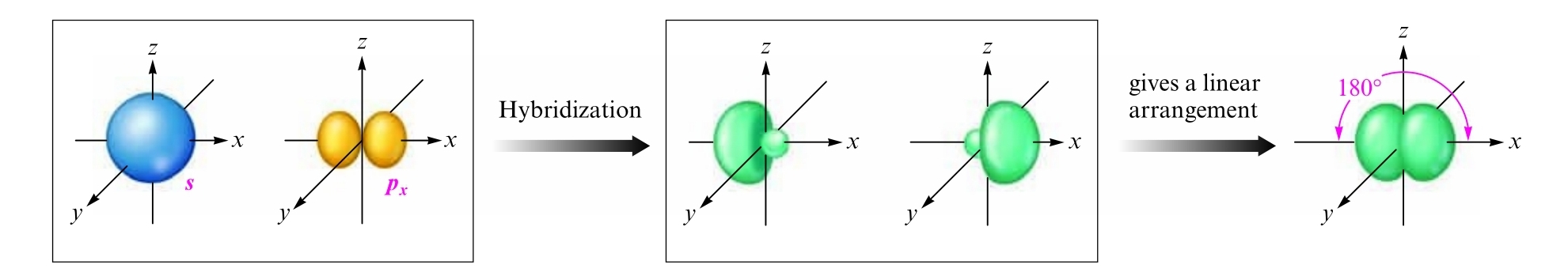
б) възникване - когато атомът в съединението участва в две еднакви връзки
Пример:
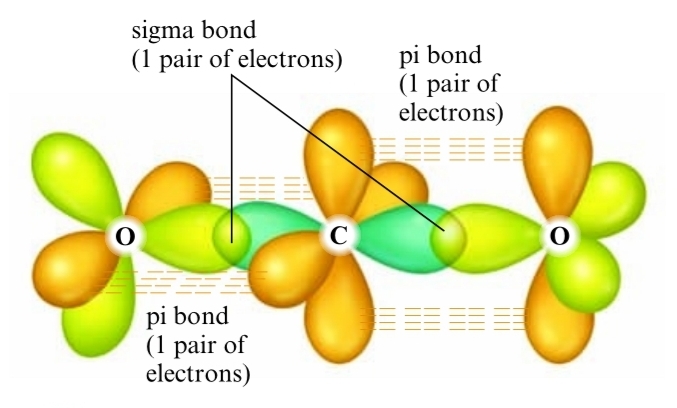
-
Недостатъци на метода на валентните връзки
- не обяснява радикалите
- не обяснява магнитните свойства на частиците
-
Метод на молекулните орбитали - молекулата се разглежда като единна квантова система, която не може да се опише чрез отделните си части
а) молекулна орбитала (МО) - решения на уравнението на Шрьодингер за самата молекула
- всяка орбитала може да съдържа максимум два електрона и то с противоположни спинове
- образуват се при взаимодействието на атомните орбитали на различни атоми - молекулната орбитала представлява линейна комбинация от взаимодействащите атомни орбитали
- броят молекулни орбитали, които се образуват, е равен на броя на взаимодействащите атомни орбитали
б) свързващи молекулни орбитали
- имат по-малка енергия отколкото изграждащите ги атомни орбитали -> има по-малка енергия отколкото атомите по отделно
- най-голямата електронна плътност се намира между ядрата на атомите
в) антисвързващи молекулни орбитали
- имат по-висока енергия от изграждащите ги атомни орбитали -> имат по-висока енергия отколкото атомите по отделно
- най-голямата електронна плътност се намира извън мястото между ядрата на атома
- бележат се като свързващите молекулни орбитали, последвани от звездичка (
*)
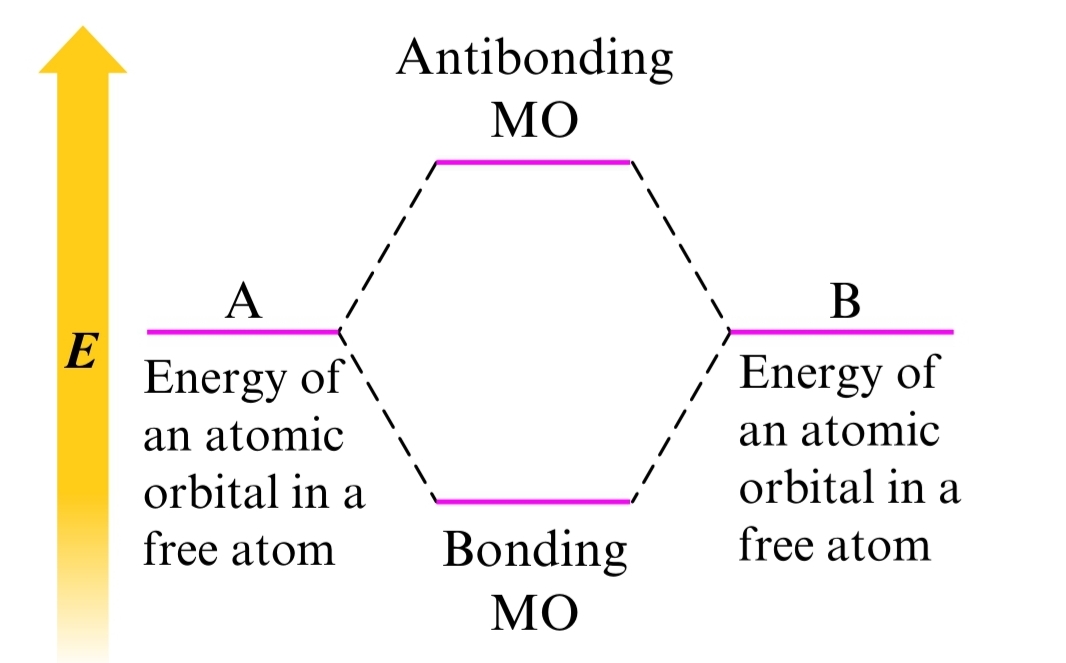
Противно на малоумните си наименования както свързващите, така и антисвързващите молекулни орбитали могат да представляват връзки.
г) електронни формули - както атомите могат да се бележат с електронни конфигурации, така и молекулите могат да се бележат с електронни формули
- изписват се молекулните обритали
- като индекс на всяка молекулна орбитала се записва точно кои атомни орбитали я образуват
- като степен се записва колко електрона се намират във въпросната молекулна орбитала
-
Молекулни орбитали на водорода - двата атома в участват с по един електрон в своите орбитали
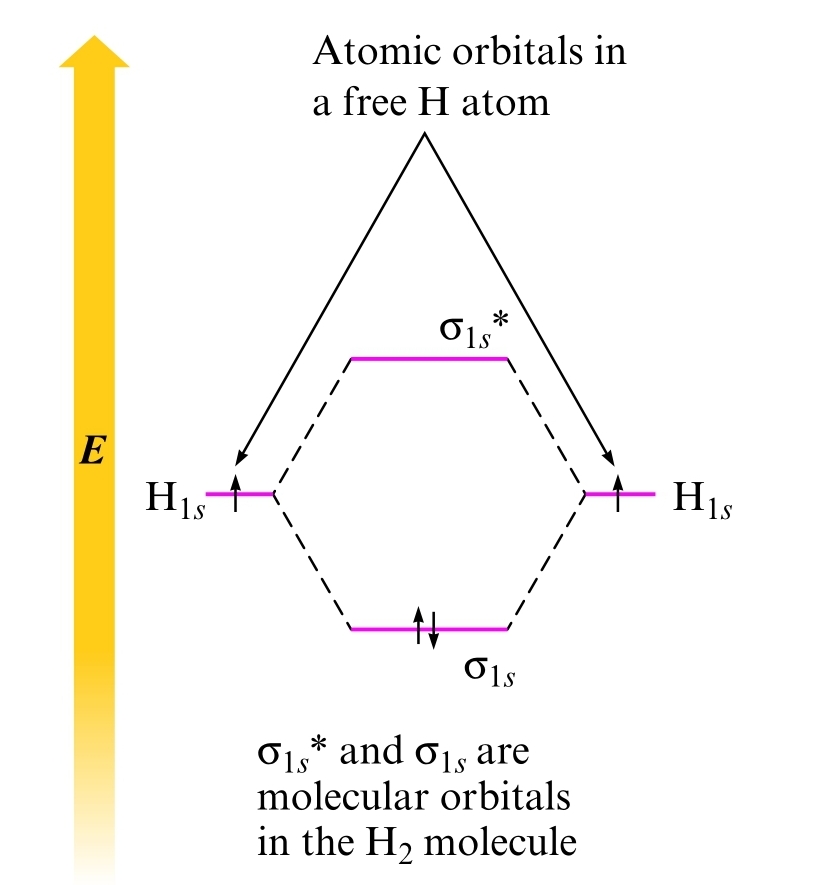 Електронна формула на :
Електронна формула на : -
Молекулни орбитали в двуатомни молекули от 2. период
а) азотоподобни молекули -
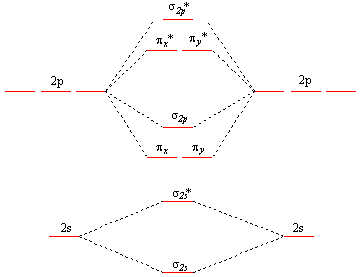
- свързващата орбитала има по-висока енергия от свързващите орбитали
б) кислородоподобни молекули -
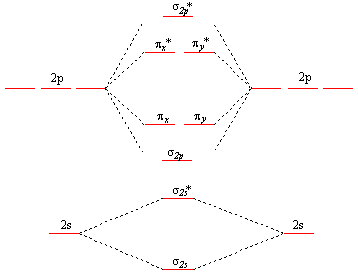
- свързващата орбитала има по-ниска енергия от свързващите орбитали
-
Порядък на връзката - мярка за стабилността на връзката
- колкото по-висок е порядъкът, толкова по-стабилна е връзкатс
-
Диполен момент () - векторна величина, характеризираща полярността на молекулите
а) диполен момент на връзка - диполният момент на дадена връзка представлява вектор, сочещ от полужителния частичен заряд към отрицателния частичен заряд на връзката
- заряд на електрона:
- дължина на връзката:
б) диполен момент на молекула - представлява векторната сума на диполните моменти на всяка от връзките
- всяка молекула, която отговаря на базовата си геометрия, е неполярна - има диполен момент
в) мерна единица - дебай
-
Степен на йонност - мярка за полярността на дадена връзка
- при степен на йонност , връзката се приема за йонна
-
Междумолекулни взаимодействия - изключително слаби сили на привличане, които възникват между молекулите и които действат на много къси разстояния
а) диполни взаимодействия (ориентационни сили) - проявяват се само при полярни молекули, като ги ориентират спрямо частичните им заряди
б) дисперсионни сили (Лондонови сили) - междумолекулни взаимодействия, които се провяват при всички молекули, но са изключително слаби
- поляризуемост на молекулите - способността на неполярни молекули спонтанно да образуват временни диполи
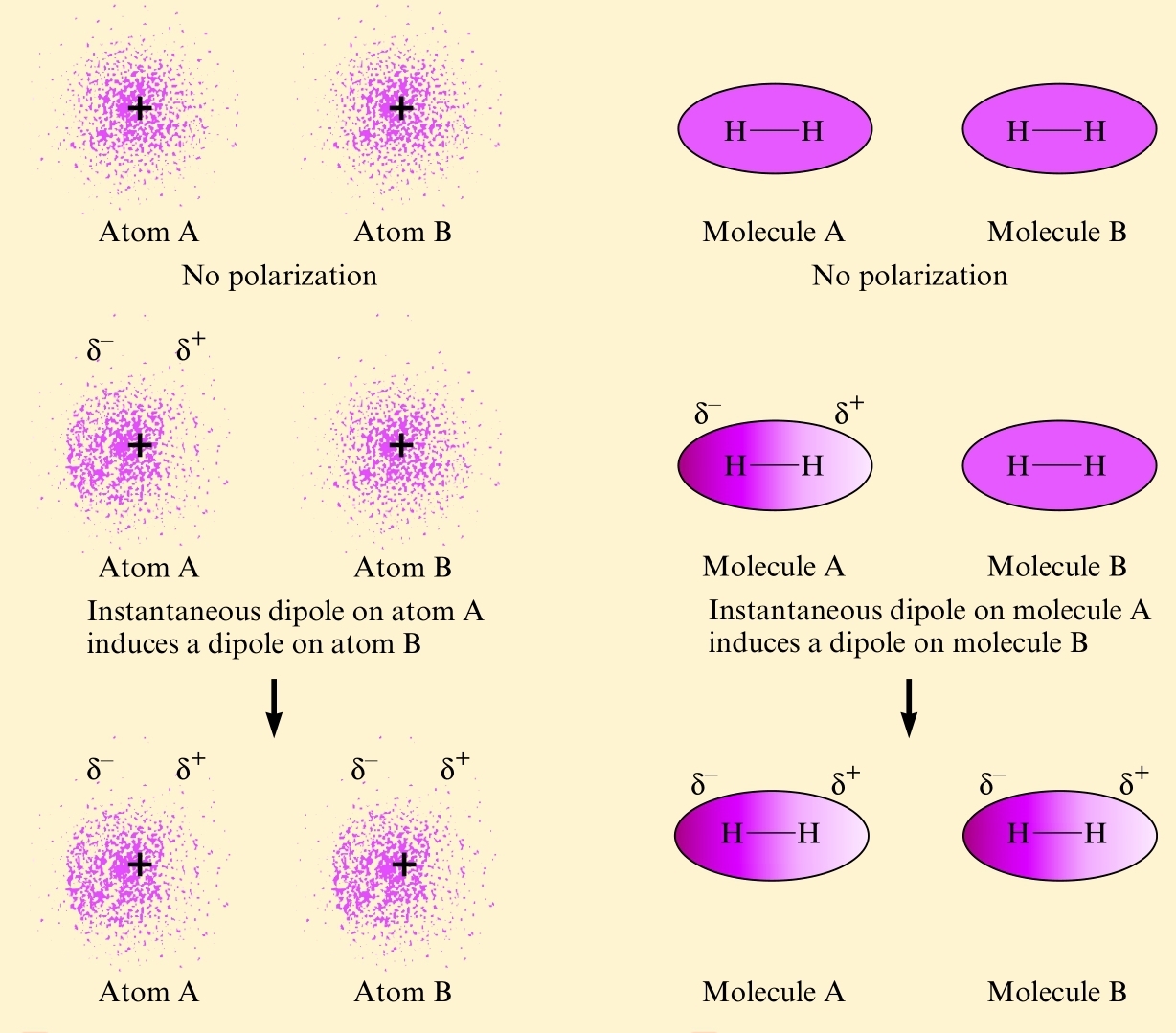
в) водородна връзка - граничен случай между химична връзка и междумолекулно взаимодействие, който е по-силен от последното и по-слаб от първото и който има съществена роля при физичните константи на веществата
- механизъм - когато водород е свързан със силноелектроотрицателен атом (), неговият положителен частичен заряд е доста голям и затова може да възникнат електростатични сили на привличане между водорода и друг силноелектроотрицателен атом () с поне една неподелена електронна двойка
-
Термодинамика - наука, изучаваща превръщането на енергия от една форма в друга и законите, по които става това
-
Термодинамична система - част от пространството, оградена от мислена или реална граница
а) видове според фазите
- хомогенна - еднаква във всяка част (1 фаза)
- хетероченна - повече от една фаза
б) по обмена с околната среда
- отворена - обменя енергия и вещества
- затворена - обменя само енергия
- изолирана - не обменя нищо
-
Термодинамични параметри - величини, характеризиращи свойствата на дадена термодинамична система
а) екстензивни - зависят от количеството
- адитивни - стойността на параметъра е сумата от стойностите за отделните компоненти
- "голям / малък"
б) интензивни - не зависят от количеството
- "висок / нисък"
-
Термодинамично състояние - съвкупността от всички свойства на дадена термодинамична система, изразени чрез параметри
а) функция на състоянието - величина, чиято стойност зависи само от текущото състояние, но не и от пътя, по който е постигнато то
б) равновесно състояние - състояние, при което всички параметри на системата остават непроменени във времето
- нулев принцип на термодинамиката - всяка изолирана система достига до равновечно състояние във времето
-
Термодинамичен процес - промяна в системата, която се проявява чрез промяна в параметрите ѝ
а) видове
- необратими - процес, който тече само в едната посока (може от да се достигне до , но от не може да се достигне до )
- обратим - процес, който може да протече и в двете посоки по един и същ път
- кръгов - процес, който тече и в двете посоки, но по различни пътища
-
Енергия - възможноста на едно тяло да извършва работа или да участва в топлообмен
а) видове
- кинетична енергия () - енергия на движението
- потенциална енергия () - съхранената в едно тяло енергия, която има свойството да се превръща в друг вид енергия
б) вътрешна енергия - общата енергия на всички частици в системата
- невъзможно е да се определи точната ѝ стойност
- функция на състоянието -> определя се нейното изменение
- промяната ѝ зависи от топлината и извършената работа
-
Обемна работа - работата, която системата извършва, когато се свива или разширява
а) разширяване - газът върши работа
б) разширяване - върху газа се извършва работа
-
Енталпия () - функция на състоянието, която характеризира топлосъдържанието в една система
а) системи под постоянно налягане - разликата в енталпията е равна на количеството обменена топлина
Доказателство:
-
Термодинамични уравнения - химични уравнения, при които се посочват агрегатните състояния на веществата и промяната в енталпията на системата
За да се сравняват реакциите, промяната на енталията на системата се дава при еднакви условия.
а) стандартни условия
- промяна в енталпията -
б) манипулация - с термохимични уравнения могат да се извършват всякакви математически преобразувания
-
Топлинен ефект на реакцията () - количеството топлина, което се отделя/по-глъща при протичането на дадена реакция
Като индекс се записва постоянната величина.
а) видове реакции
- екзотермични - отделя се топлина ()
- ендотермични - поглъща се топлина ()
-
Закон на Хес - общата промяна в енталпията е сума от промените в енталпията на отделните етапи
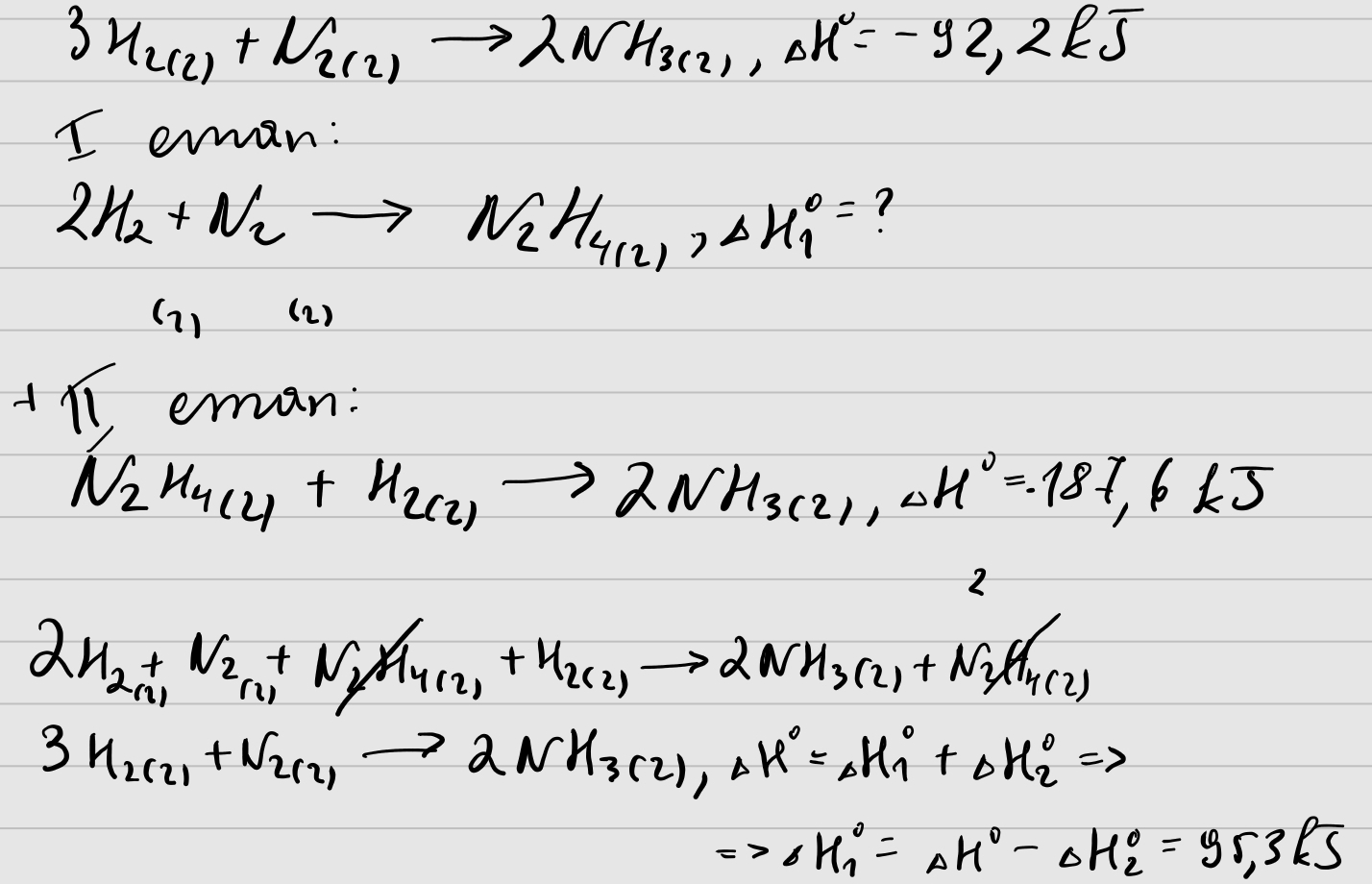
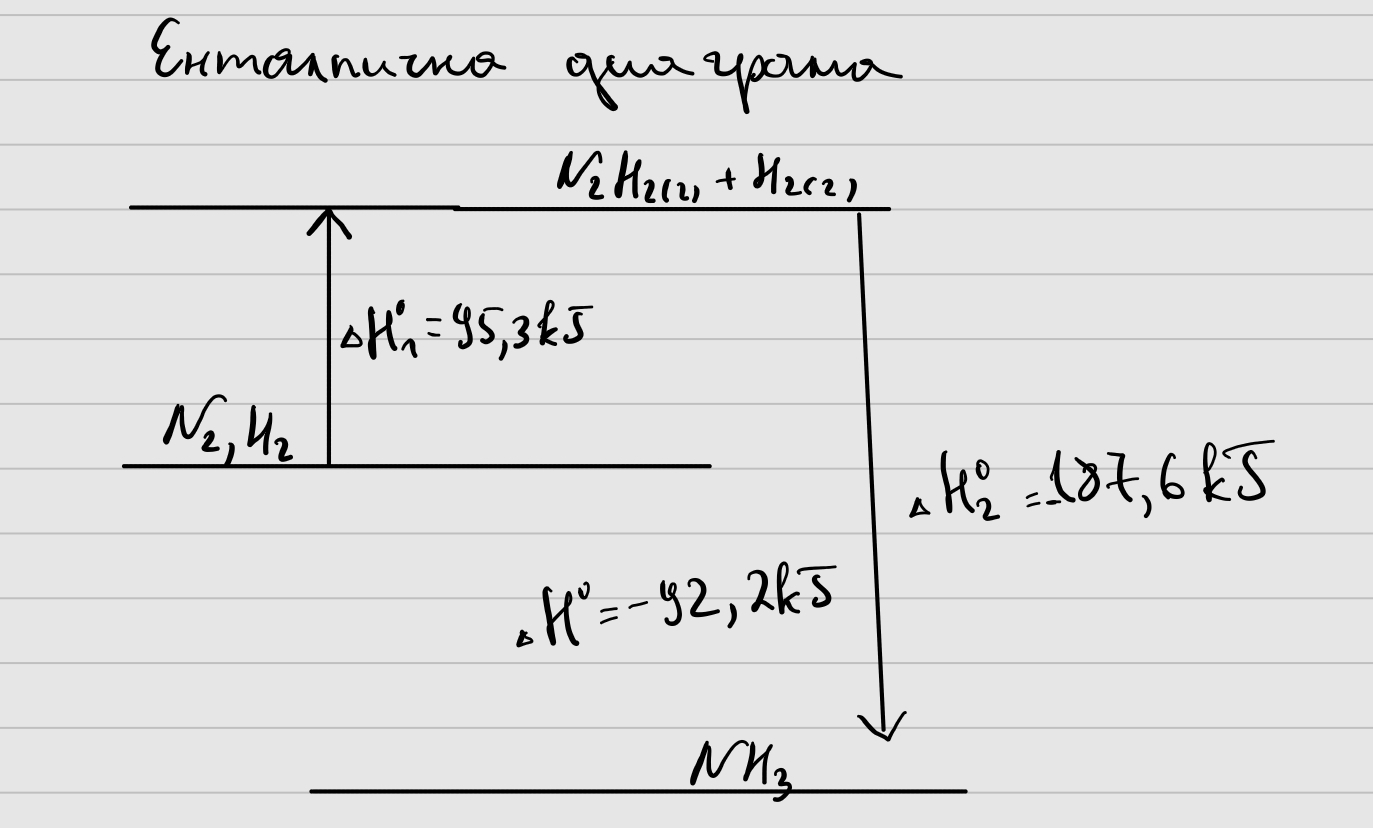
-
Стандартна енталия на образуване () - промяната в енталията при образуване на 1 мол вещество при стандартни условия от съответните, стабилни при стандартни условия, прости вещества
а) критерий за стабилност - по-отрицателната стандартна енталпия на образуване означава по-стабилно съединение
- стандартната енталпия на образуване на стабилни при стандартни условия прости вещества е нула
-
Калориметрия - експериментален метод за определяне топлинните ефекти на химичните реакции
а) калориметър - изолирана система под постоянно налягане
-
Топлинен капацитет - количеството топлина, нужно за повишаването на температурата с 1° С
а) специфична топлоемкост () - количеството топлина, нужно за повишаването на температурата на 1 килограм вещество с 1° К
б) молна топлоемкост () - количествато топлина, нужно за повишаването на температурата на 1 мол вещество с 1° К
-
Термодинамична вероятност () - броят микросъстояния, с който може да се реализира дадено мокросъстояние
-
Ентропия () - функция на състоянието, която характеризира безпорядъка на дадено състояние
а) уравнение на Болцман - начин за изчисляване на ентропията
- константа на Болцман:
б) стандартна молна ентропия () - ентропията на 1 мол от дадено вещество при стандартни условия
- таблична стойност
в) трети принцип на термодинамиката - когато температурата клони към абсолютната нула, ентропията също клони към нула
- ентропията на перфектно подреден идеален кристал е нула
-
Промяна в ентропията прицхимични реакции () - разликата в стандартните молни ентропии на продуктите и стандартните молни ентропии на реагентите
-
Промяна в ентропията прицхимични реакции () - разликата в стандартните молни ентропии на продуктите и стандартните молни ентропии на реагентите
а) промяна в ентропията на системата
б) промяна в ентропията на вселената
-
Спонтанност - свойството на един процес да протича без външна намеса
а) втори принцип на термодинамиката - един процес е спонтанен тогава и само тогава, когато води до увеличение в ентропията и на системата, и на вселената
-
Енергия на Гибс () - функция на състоянието, обвързваща температурата, ентропията и енталията на системата
а) промяна в енергията на Гибс ()- критерий за спонтанност на процесите
- - процесът е неспонтанен
- - процесът е в равновесие
- - процесът е спонтанен
б) стандартна енергия на Гибс на образуване () промяната в енергията на Гибс при образуване на 1 мол вещество при стандартни условия от съответните, стабилни при стандартни условия, прости вещества
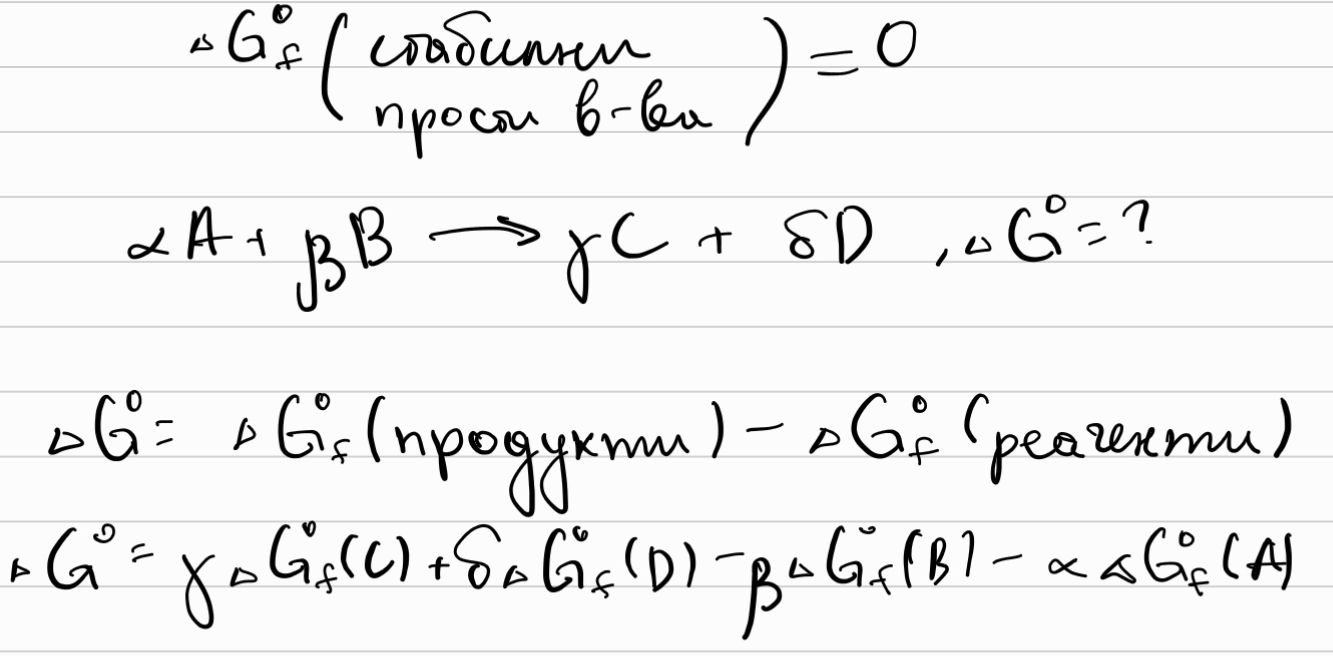
-
Реакционно отношение - отношението между дадена величина на продуктите и същата величина на реагентите
а) реакционно отношение на концентрациите ()
- мерна единица:
б) реакционно отношение на парциалните налягания
в) реакционно отношение на молните части
- безразмерна величина
г) свойства
- нормиране - стойностите, участващи в израза за дадено реакционно отношение, изкуствено се разделят на тези при стандартни условия, за да паднат мерните единици
- реакционното отношение на обратната реакция е реципрочно на реакционното отношение на правата реакция
д) промяна в моловете ()
-
Химично равновесие - състояние, при което концентрациита на всички вещества остават постоянни във времето
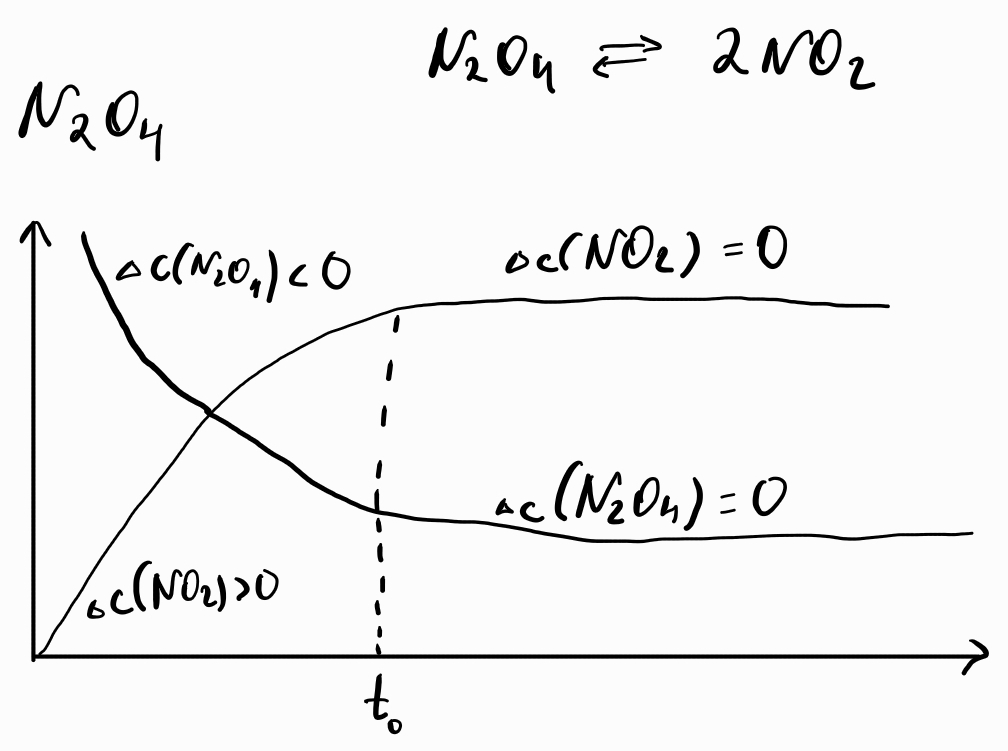
а) условия - за химично равновесие може да се говори само когато са налице следните фактори
- затворена система
- постоянни температура и налягане - равновесното състояние е функци1 на налягането и температурата
б) причина - правата и обратната реакция протичат с една и съща скорост
в) означение - когато дадена химична реакция се намира в равновесие, тя се обозначава с две противоположни полустрелки ()
-
Равновесна константа - реакционно отношение за система в равновесие
а) концентрационна равновесна константа ()
- равновесна молна концентрация - концентрацията на веществото при равновесие
- зависи единствено от на веществата и температурата
- закон за действие на масите:
- концентрационната равновесна константа на реакция, протичаща на няколко етапа, е произведението от концентрационните равновесни константи на отделните етапи:
б) равновесна константа за молните части ()
в) равновесна константа за парциалните налягания ()
- връзка с :
Доказателство:
- връзка с :
Доказателство:
-
Оценка на количествения състав на равновесната смес - чрез равнивесните константите може да се прецени дали в сместа при равновесие има повече продукти или повече реагенти
Проебладават реагентите. Съизмерими количества на реагентите и продуктите. Преобладават продуктите. -
Посока на реакциите - протича тази реакция, която доближава системата до равновесие
а) определяне - чрез сравняване на реакционното отношение на системата с равновесната ѝ константа за дадената температура
- протича правата реакция
- протичат и двете реакции (системата е в равновесие)
- протича обратната реакция
-
Принцип на Льо Шаталие-Браун - ако върху равновесна система се окаже външно въздействие, то протича тази реакция, която ще намали ефекта му
а) концентрация - системата излиза от равновесие
- добавяне на изходно вещество (не твърдо или течно) -> протича правата реакция
- добавяне на продукт (не твърдо или течно) -> протича обратната реакция
б) налагяне и обем - системата излиза от равновесие
- повишаване на налягането (намаляне на обема) -> протича реакцията, която намалява обема
- намаляване на налягането (увеличаване на обема) -> протича реакцията, която увеличава обема
в) температура - самото равновесно състояние се измества
- повишаване на температурата -> протича ендотермичната реакция
- понижаване ня температурата -> протича екзотермичната реакция
-
Изменение в енергията на Гибс при реакции, протичащи при условия, различни от стандартните
- промяна в енергията на Гибс при стандартни условия:
- универсална газова константа:
- температура:
- реакционно отношение:
а) изчисляване на на реакциите
Доказателство:
При равновесно състояние
-
Реакционна изотерма на Ванд-Хоф - уравнение за изчисляване на равновесната константа
а) изчисляване на чрез
-
Фаза и агрегатно състояние
а) фаза - хомогенна част от хетерогенна система
б) агрегатно състояние - състояние на веществата, което се характеризира с точно определени качествени свойства
- всяко агрегатно състояние е отделна на фаза, но обратното не е задължително
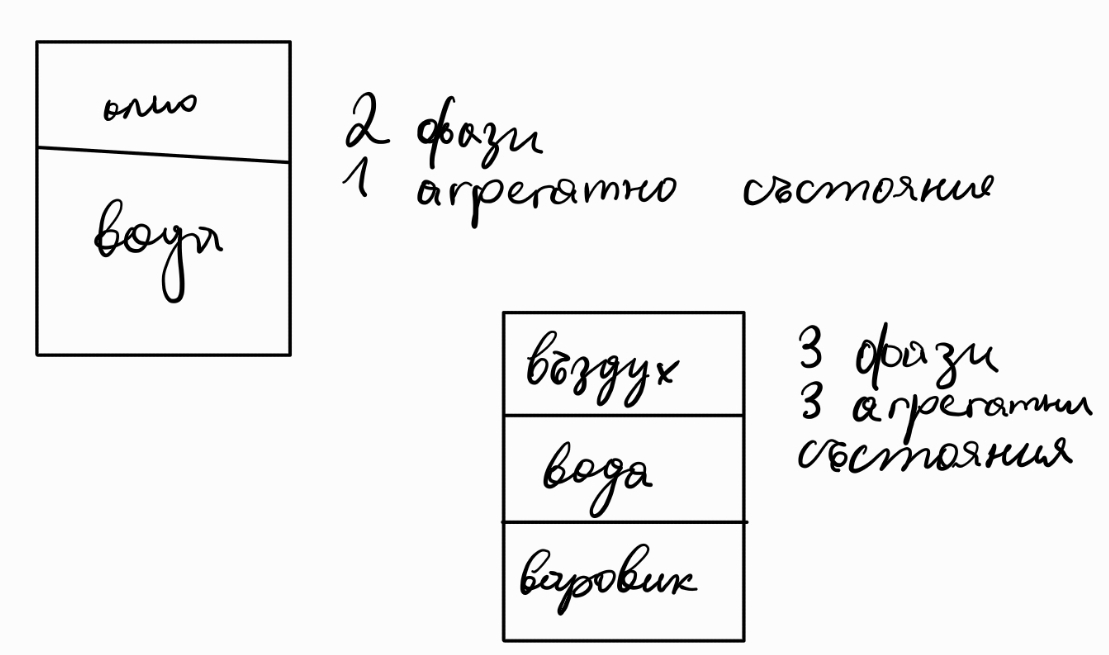
-
Фазови преходи
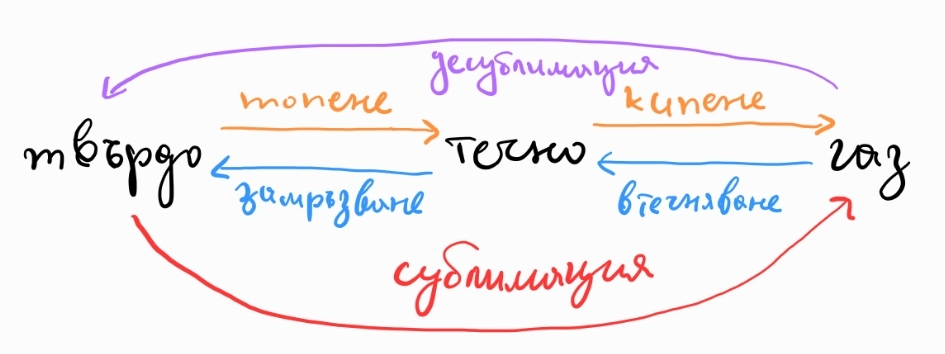
а) топене - спонтанно при високи температури
б) замръзване - спонтанно при ниски температури
в) гранични температури
-
Крива на загряване / охлаждане - графично представяне на количеството топлина, което се обменя при преходите на едно вещество между различните му фази
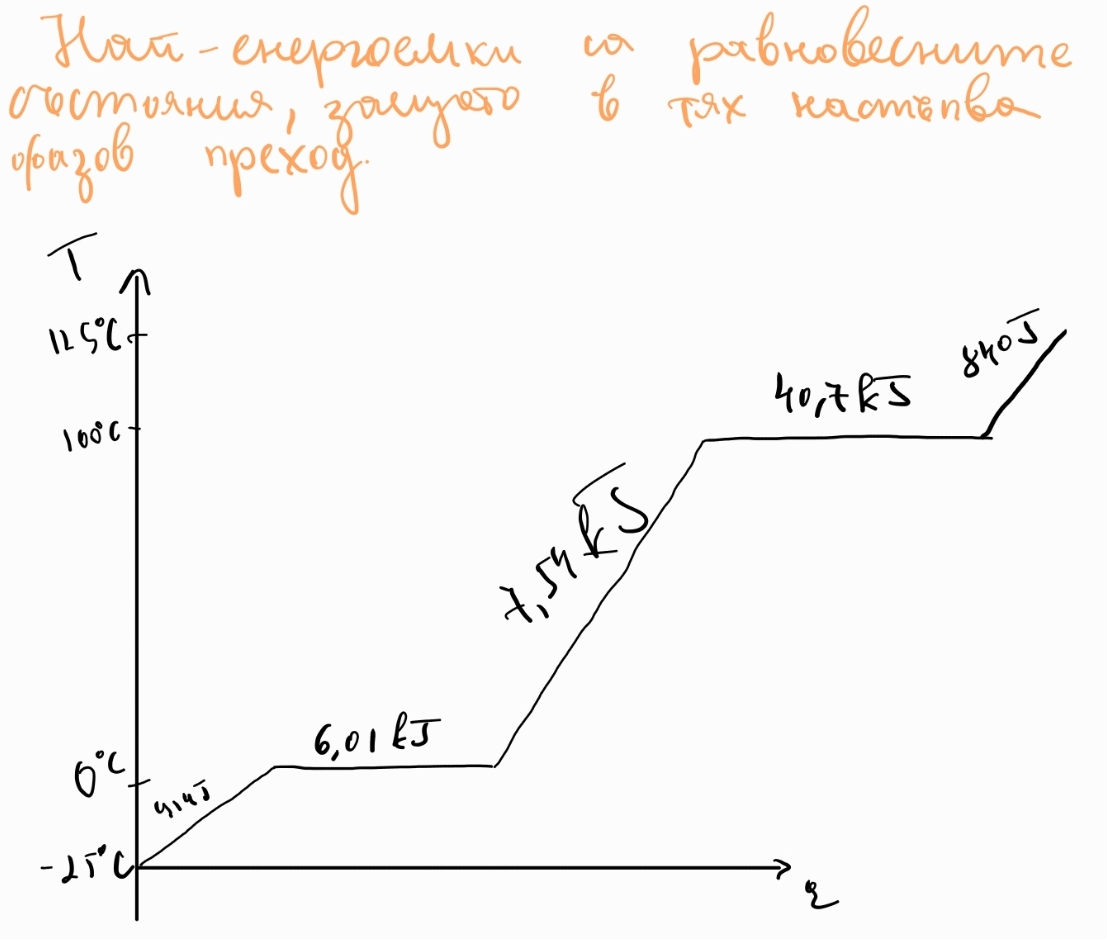
-
Изпарение - спонтанен процес на преминаване от течно в газообразно състояние, който засяга само повърхността на течността и протича при всякаква температура, като се благоприятства от висока такава
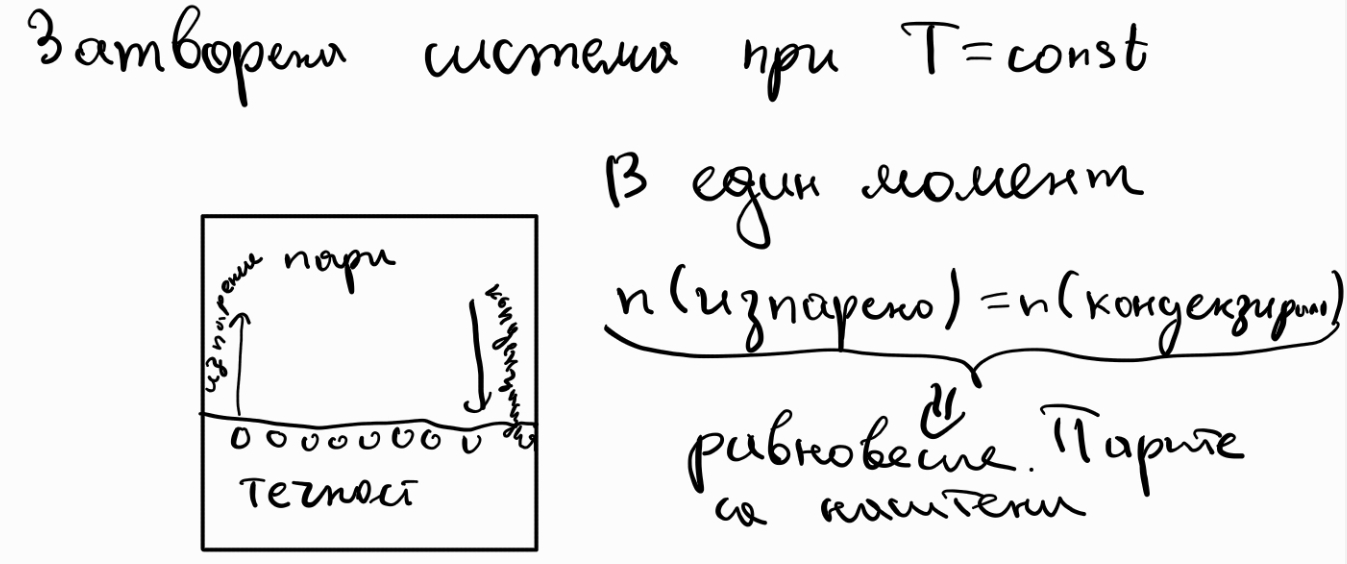
а) парно налягане - налягането, което наситените пари на веществото оказват върху течната му фаза
- наситени пари - парите на веществото, когато изпарението е в равновесие ()
- уравнение на Клаузиус-Клапейрон - зависимост межу парното налягане и температурата
-
Кристална решетка - правилна геометрична структура, повтаряща се в пространството, в която могат да се подредят частиците на твърдите вещества
а) елементарно звено - най-малката правилна геометрична структура, от която чрез трансляция може да се получи цялата кристална решетка
б) кубична елементарна клетка - характерна за металите
Единично звено - куб Решетка Върхове 8 1 връх се споделя от 8 куба Ръбове 12 1 ръб се споделя от 4 куба Стени 6 1 стена се споделя от 2 куба - видове
Примитивна (pcc) Обемноцентрирана (bcc) Стенноцентрирана (fcc) Модел 
Характеристика 1 атом във всеки връх 1 атом във всеки връх; 1 атом в центъра 1 атом във всеки връх; 1 атом в центъра на всяка стена Брой атоми в елементарна клетка Пример пулоний алкални метали цветни метали -
Фазови диаграми - графично представяне на фазите фазовите преходи, равновесията и характерните физични константи за хетерогенни системи
а) елементи
- области - показват фазите
- криви - показват равновесните състояния
- точки - показват характерни константи
б) на еднокомпонентни системи - показват зависимостта на състоянието на системата спрямо налягането и температурата
- тройна точка - точката, в която могат да съществуват твърдо, течно и газообразно състояние едновременно
- критична точка - точката, в която течното и газообразното състояние стават неразличими
в) на поликомпонентни системи
- диаграма на топене - показва зависимостта на фазите на системата като зависимост от молните части на нейните компонентни и температурата
г) правило на Гибс
- брой степени на свобода () - броят параметри, които можем да варираме, без да променяме състоянието
- брой компонентни в системата -
- брой фази в системата -
- Фракционна дестилация - метод за разделяне на течни смеси на основните им компоненти
-
Разтвор - хомогенна смес, съдържаща поне две вещества, между които не протича химична реакция
а) разтворител - веществото в най-голямо количество
- определя агрегатното състояние на разтвора
б) разтворени вещества - всички останали вещества в разтвора
-
Разтваряне - процес на разпределяне на частиците на разтвореното вещество между частиците на разтворителя
а) подобни се разтварят в подобни - разтварянето се осъществява, когато междумолекулните взаимодействия между частиците на разтворителя са подобни на тези между частиците на разтвореното вещество
- полярни вещества се разтварят в полярни разтворители
- неполярни вещества се разтварят в неполярни разтворители
б) механизъм на разтваряне
- без дисоциация - броят на частиците в разтвора остава непроменен
- с дисоциация - броят на частиците в разтвора се увеличава
Дисоцират се електролитите - соли, киселини и основи.
в) термодинамика на разтварянето
- разтваряне на твърдо вещество в течност - зависи от веществата
- разтваряне на газ в течност - обикновено е екзотермичен процес
-
Разтворимост - свойството на едно вещество да се разтваря в даден разтворител
а) видове разтвори
- ненаситен - разтвор, в който може да се разтваря още вещество;
- наситен - разтвор, при който концентрацията е максимална, защото разтварянето и кристализацията са в равновесие; характеризира се с концентрация
- преситен разтвор - нестабилен разтвор, който временно има концентрация, по-висока от тази на наситения разтвор
б) мярка за разтворимост - концентрацията на наситения разтвор ()
в) фактори
- природата на веществата
- температура
- при разтваряне на твърдо вещество в течност - няма обща зависимост
- при разтваряне на газ в течност - разтворимостта намалява с увеличаване на температурата
- налягане - Закон на Хенри
-
Общи свойства на разтворите - свойства, които зависят само от количеството разтворено вещесто, но не и от неговата природа
Важат само за силно разредени разтвори.
-
Парно налягане над разтворите
а) над разтвор на нелетливо вещество - парното налягане се дължи само на разтворителя
- първи закон на Раул - парното налягане е по-ниско от това над чистия разтворител
б) над разтвор на летливо вещество - парното налягане се дължи и на разтворителя и на разтвореното вещество
-
Температури на кипене и замръзване
а) закон на Бекман
- изотоничен коефициент ( )
- ебулиоскопска константа ( ) - зависи само от разтворителя
- молална концентрация на разтвора ( )
б) втори закон на Раул
- изотоничен коефициент ( )
- криоскопска константа ( ) - зависи само от разтворителя
- молална концентрация на разтвора ( )
-
Осмотично налягане
а) осмоза - процес на преминаване на частиците на разтворителя от по-разреден разтвор в по-концентриран посредством полупропусклива мембрана
б) осмотично налягане ( ) - налягането, което по-концентрираният разтвор оказва върху полупропускливата мембрана, когато осмозата достигне равновесие
- закон на Ванд-Хоф:
-
Дисперсна система - хетерогенна система, съдържаща поне 2 компонента, между които не протича реакция
В дисперсната система е налична фазова граница, било то видима или невидима за простото око.
а) дисперсна среда - компонентът в най-голямо количество
- определя агрегатното състояние на дисперсната система
б) дисперсна фаза - компонентът в по-малко количество
-
Видове дисперсни системи
а) според размера на частиците
- разтвор:
- колоид:
- грубодисперсна система:
б) според агрегатните състояния
Дисперсна среда Дисперсна фаза Наименование Примери газ течност мъгла, сапунена пяна газ твърдо аерозол дим течност газ газирана напитка течност течност емулсия кръв, прясно мляко течност твърдо суспензия варно мляко твърдо газ твърда пяна стиропор твърдо течно кристалохидрат твърдо твърдо сплав чугун, стомана
-
Абсорбция - процес на проникване на частиците от една фаза в обема на друга, преминавайки през фазовата граница
-
Адсорбция - процес, при който частиците на една фаза прилепват по базовата граница, без да преминават в другата фаза
а) физична адсорбция
- по-слаби междумолекулни взаимодействия
- обратим процес
б) хемисорбция (химична адсорбция)
- протичане на реакция
- необратими процес
- често има и абсорбция
в) адсорбционна изотерма графика, представяща адсорбцията като функция на концентрацията или парцалното налягане на адсорбата
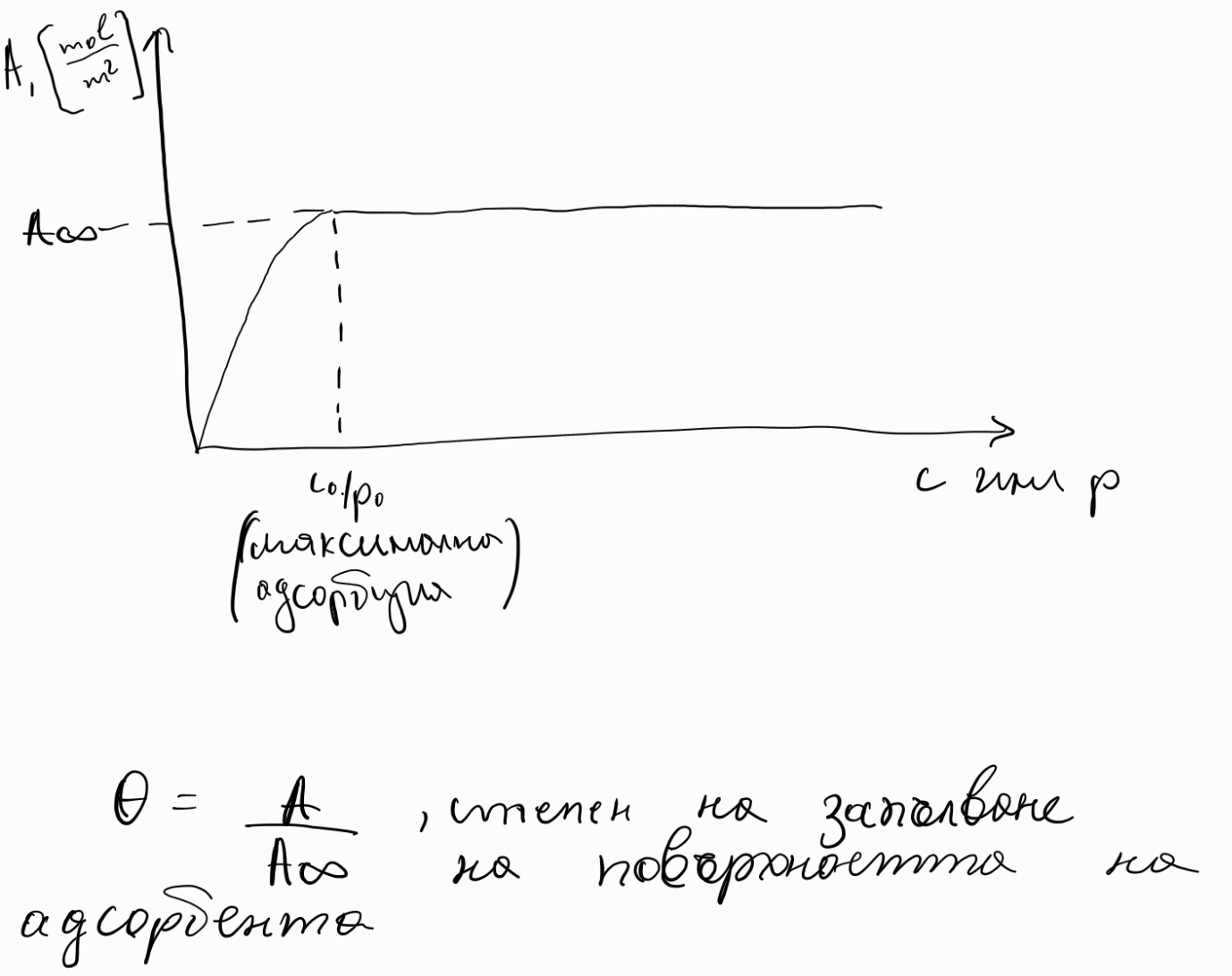
-
Колоид - дисперсна система, чиято дисперсна фаза има частици с размер между 1 и 100 нанометра
Фазовата граница при колоидите не се вижда с просто око.
-
Лиофилни (молекулни) колоиди
а) характеристики
- има силно взаимодействие между частиците на дисперсната среда и тези на дисперсната фаза
- дисперсната фаза поглъща част от дисперсната среда (абсорбция)
- ако дисперсната среда е вода, се наричат хидрофилни
-
Лиофобни (мицеларни) колоиди
а) характеристики
- има слабо взаимодействие между частиците на дисперсната среда и тези на дисперсната фаза
- частиците на дисперсната фаза задържат част от частиците на дисперсната среда върху повърхността си (адсорбция)
- частиците се наричат мицели
б) строеж на мицела
- ядро - изградено от частиците на дисперсната фаза
- адсорбционен слой - слоят над ядрото, който съдържа потенциалоопределящите йони
Правило на Памет-Фаянс: В адсорбционния слой се натрупват онези йони от веществото в излишък, които участват в образуването на неразтворимото съединение. Ядрото и адсорбционният слой образуват гранулата на мицела.
- дифузен слой - слоят около гранулата, който е изграден от противозарядните на тези в адсорбционния слой йони
в) формула на мицела
- количество на йоните в ядрото:
- количество на йоните в излишък:
- количество ма йоните в дифузния слой:
-
Свойства на колоидите
а) кинетични свойства
- Брауново движение
- дифузия и осмоза
- по-ниска скорост на движение на частиците -> по-ниско осмотично налягане
б) електрични свойства
- електрофореза - движение на мицелите спрямо заряда на гранулата към съответния електрод
в) оптични свойства
- имат цвят
- опалесценция - изглеждат мътни
- Тиндалов ефект (конус на Тиндал) - лъч светлина се вижда и превръща в конус
-
Стабилност на колоидите - по-стабилни от грубо дисперсните системи, но по-нестабилни от разтворите
-
Електролит - киселина, основа или сол
а) свойства на електролитите
- силно полярни или йонни връзки
- дисоцират се във воден разтвор / стопилка
- водните им разтвори / стопилките провеждат електричен ток
-
Степен на електролитна дисоциация () - величинаю показваща каква част от електролита се дисоцира
а) видове електролити
- слаби електролити:
- силни електролити:
-
Силни електролити
а) харсктеристики - теория на Дебай и Хюкел
- дисоциацията е практическо необратим процес
- силните електролити се дисоцират 100% във вода ( )
- всеки дисоциран йон се ображда от слой противозарядни йони (т. нар. "противойонна атмосфера") и възникналите електростатични взаимодействия правят да изглежда сякаш в разтвора е дисоцирана само част от силния електроли
б) активност ( ) - величина, характеризираща "активната" концентрация на йоните в разтвора и представляваща заместител на величината за силни електролити
- активитетен коефициент ( ) - отчита междуйонните взаимодействия в разтвора
- концентрация на йона в разтвора при стандартни условия ( )
При силно разредени разтвори активитетният коефициент клони към едно и активността съвпада с концентрацията на йона.
в) йонна сила на разтвора ( ) - количествена характеристика на междуйонните взаимодействия в разтвора
- концентрация на -тия йон ( )
- формален заряд на -тия йон ( ) - целочослен заряд
- концентрация на -тия йон при стандартни условия( )
Активитетният коефициент за всеки електролит е един и същ в разтвори с еднаква йонна сила.
-
Слаби електролити
а) характеристики
- дисоциацията е обратим процес
- дисоциацията винаги е ендотермичен процес
б) дисоциационна константа ( ) - равновесната концентрационна константа за процеса на дисоциация
- закон на Оствалд - разреждането благоприятства дисоциацията
-
Теория на Арениус
а) основни понятия
- киселина - вещество, което във воден разтвор като катиони отделя само
- основа - вещество, което във воден разтвор като аниони отделя само
-
Теория на Брионстед и Лоури (Протолитна теория) - описва най-добре и най-просто неорганичните киселини и основи
а) киселина - вещество, което във воден разтвор отделя протони ( )
- всички киселини съдържат водород
б) сила на киселина - силата на киселината зависи от способността ѝ да отделя и най-вече от стабилността на получаващия се анион
- колкото по-полярна е връзката с водорода, толкова по-лесно тя се разкъсва във воден разтвор
- колкото повече резонансни структури има получаващият се анион, толкова по-стабилен е той
Сила на безкислородни киселини () Сила на оксикиселини () По групи - нараства отгоре надолу, защото
По периоди - нараства от ляво надясно, защотоПравопропорционална на електроотрицателността на останалите атоми и техния брой, защото те изтеглят връзката към кислородния атом в) основа - вещество, което във воден разтвор приемв протони ( )
г) неутрализация - процес на пренос на от киселината към основата
Едно вещество може да бъде киселина или основа в зависимост от партньора си.
- протолитна двойка - киселина и спрегната ѝ основа ( ) или основа и спрегната ѝ киселина ( )
- неутрализацията протича до равновесие в тази посока, която намалява силата и на основата, и на киселината
Колкото по-силна е киселината, толкова по-слаба е спрегнатата ѝ основа и обратно.
Колкото по-силна е основата, толкова по-слаба е спрегнатата ѝ киселина и обратно.
-
Теория на Люис (Електронна теория) - най-точната теория за киселини и основи, която ги описва и извън водни разтвори и е много важна за органичната химия
а) Люисова киселина (електрофил) - вещество с празна атомна орбитала или положителен заряд
б) Люисова основа (нуклеофил) - вещество с неподелена електронна двойка или отрицателен заряд
в) неутрализация - процес на споделяне на цяла електронна двойка между основа, отделяща електронната двойка, и киселина, приемаща електронната двойка
-
Автопротолиза - процес, при който едно вещество реагира само със себе си едновременно като киселина, и като основа
а) амфолит - вещество, което може да бъде и основа, и киселина
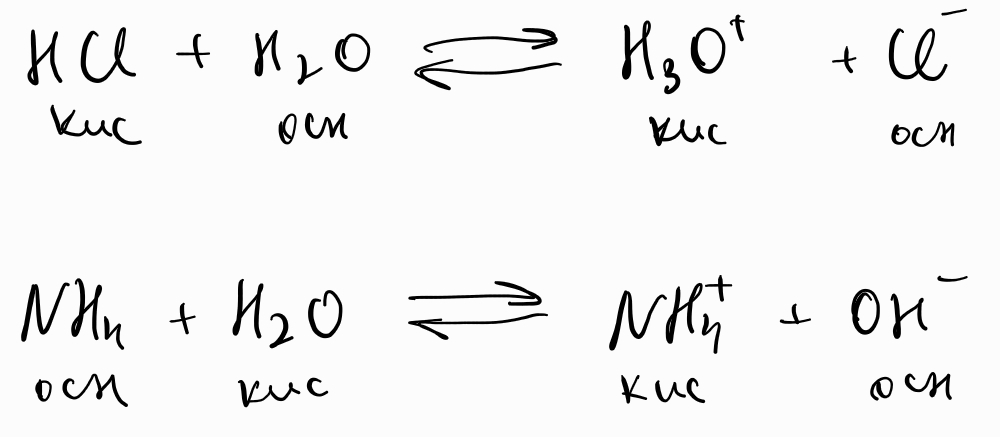
-
Йонно произведение на водата () - дисоциационната константа на водата
За разредени разтвори, не зависи от количеството на разтвореното вещество.
а) йонно произведение на водата при стандартни условия ()
б) сила на протолитни двойки
Доказателство:
-
Водороден показател ()
Значещите цифри на са колкото са значещите цифри в концентрацията на хидроксониевите йони.
а) киселинност на водните разтвори
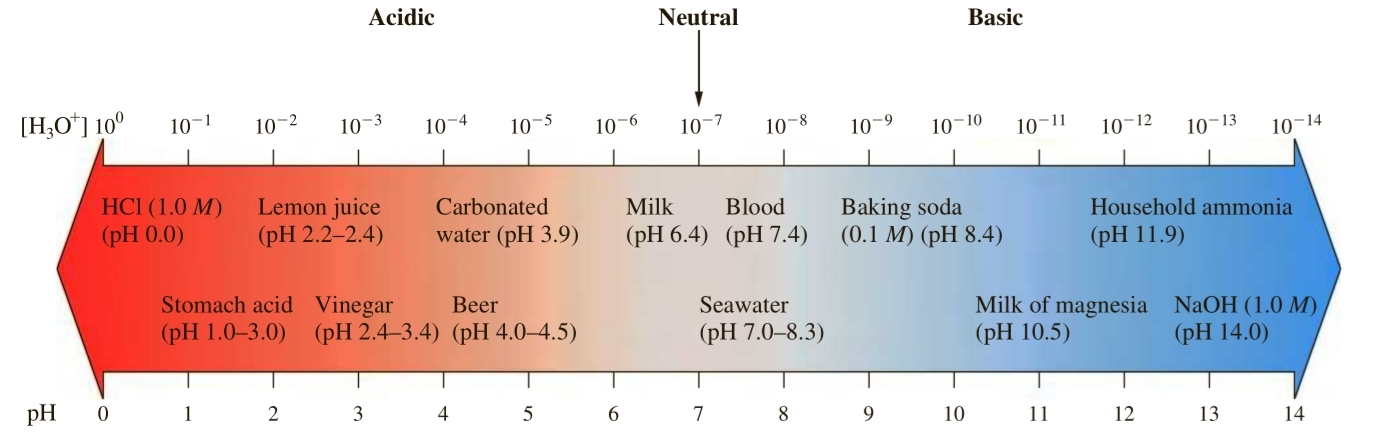
Киселинни Неутрални Основни б) определяне на
- чрез индикатор - слаба киселина, която има различно оцветяване в киселинна и основна среда
Индикатор Област на валидност фенолфталейн малиненочервен:
иначе безцветен- чрез -метър
в) функцията - отрицателен десетичен логаритъм на дадена величина
-
Теория на Арениус
а) сол - вещество, което във воден разтвор или в стопилка се дисоцира до метални (или амониеви) катиони и киселинни аниони
б) видове соли
- дисоцират се до един вид катиони и един вид аниони
- хидрогенсоли (киселинни соли) - дисоцират се до един вид катион, и един киселинен анион
- хидроксосоли (основни соли) - дисоцират се до метален (или амониев) катион, и основен йон
- двойни соли - дисоцират се до два вида метални (или амониеви) катиони и киселинен анион
- комплексни соли
-
Хидролиза - протолитно взаимодействие между йоните на сол и водата, при което се променя на разтвора
Киселина Основа Разтвор на съответната сол Пример силна силна неутрален
Натриевите катиони са инертни, защото са катиони на алкален метал, а хлорните аниони са много слабо основни, защото са спрегнати на силна киселина. Следователно йоните не са способни да депротонират водата и не протича реакция.силна слаба киселинен
Амониевите катиони са силно киселинни, защото са спрегнати на слабата амонячна основа, а нитратните аниони са слабо основни, защото са спрегнати на силната азотна киселина. Следователно йоните ще протонират водата и разтворът ще има киселинен характер.слаба силна основен
Натриевите катиони са инертни, а цианидните аниони са силно основни, защото са спрегнати на слабата циановодородна киселина. Следователно йоните ще депротонират водата и разтворът ще има основен характер.слаба слаба зависи
Амониевите катиони са силно киселинни, защото са спрегнати на слабата амонячна основа, а карбонатните аниони са силно основни, защото са спрегнати на слабата въглеродна киселина. Това означава, че в разтвора ще протекат две реакции:
Ако , разтворът е киселинен. Ако , разтворът е основен.
-
Буферен разтвор - разтвор на слаба киселина или слаба основа, към който е добавен съответната ѝ сол
а) свойства
- при добавяне на някакъв друг електролит в разтвора, остава сравнително непроменено
б) механизъм на действие
- добавените частици на спрегнатата основа / киселина нарушават равновесието и протича реакцията, която синтезира първоначалната киселина / основа, до възстановяване на баланса
- това покачва концентрацията на първоначалната киселина / основа, защото обемът на разтвора остава непроменен
- самото на разтвора обаче остава едно и също, защото не се добавят йони
- по този начин и концентрацията на първоначалната киселина / основа, и тази на спрегнатата ѝ основа / киселина са по-високи отколкото, ако беше само първоначалното количество киселина / основа
- ако сега в разтвора се добави друг електролит, ще се промени съвсем малко, защото има едновременно допълнително киселина и допълнително основа, които да неутрализират добавения електролит
-
Уравнение на Хендерсон-Хаселбах - за изчисляване на на буферен разтвор
-
Характеристики на буферните разтвори
а) буферен капацитет () - концентрацията на киселина / основа, която може да се добави преди да се промени с едно
б) област на действие
-
-метър - галваничен елемент с водороден анод и референтен катод
а) водороден анод - газът водород се продухва под налягане
б) референтен катод - катод с известен електроден потенциал
- каломелов референтен катод - най-често използваният
в) механизъм на действие
- -метърът се потапя в разтвора с неизвестно
- измерва се ЕДН (), което създава галваничният елемент на -метъра
- изчислява се електродното напрежение на водородния анод
- използва се уравнението на Нернст
-
Галванотехника - нанасяне на метални покрития
а) галваностегия - нанасяне на метално покритие върху друг метал
б) галванопластика - изработка на метални копия на предмети
-
Степен на окисление - хипотетичният заряд, който даден атом бил имал, ако всички връзки в съединението се приемат за йонни
а) означение - изписва се над атома, като първо се изписва знакът, а след това числото
б) определяне
- просто вещество- нула
- метали от А групите - винаги имат положителна степен на окисление, съвпадаща с номера на групата
- водород - винаги +1, като само в хидридите е -1
- кислород - винаги -2, освен в супероксидите и пероксидите
Алгебричната сума от степените на окисление в дадено съединение е равна на общия заряд на съединението.
-
Окислително-редукционен процес (ОРП) - процес на пренос на електрони, при който се променя степента на окисление на някои или всички участващи вещества
Всеки окислително-редукционен процес има две полуреакции.
а) окисление - процес на отдаване на електрони
- редуктор - частица, отдаваща електрони
- степента на окисление на редуктора нараства
б) редукция - процес на приемане на електрони
- окислител - частица, приемаща електрони
- степента на окисление на окислителя намалява
-
Видове окислително-редукционни процеси
а) междумолекулни - преносът на електрони става между различни вещества
б) вътрешномолекулни - преносът на електрони става между атоми на едно и също вещество
в) диспропорционирани - частици на едно и също вещество играят ролята и на окислител, и на редуктор
-
Съставяне и изравняване на уравнение на ОРП
а) изравняване - метод на електронния баланс
- записват се реакциите на окисление и редукция и броят на електроните, които се отдават / приемат
- намира се НОК на броя на електроните, участващи в двата процеса
- коефициентите пред редуктора / окислителя са равни на НОК, разделено на броя електрони, участващи в съответния процес
Брой електрони НОК Коефициент 5 20 4 4 20 5 б) метод на полуреакциите - начин за съставяне и изравняване на уравненията на окислително-редукционни процеси, протичащи във воден разтвор
- записват се двете полуреакци
- изравняват се елементите, без да се взимат водородът и кислородът предвод (това в готово в този случай)
- към страната с по-малко кислород се добавя толкова вода, че да уравновеси броя кислородни атоми от двете страни
- към страната с по-малко водород се добавят толкова водородни положителни йони, че да уравновесят водорода в от двете страни
- в уравнението на окислението, отдясно, се добавят толкова електрона, че общият заряд (не степен на окисление!) от двете страни да стане еднакъв
- в уравнението на редукцията, отляво, се добавят толкова електрона, че общият заряд (не степен на окисление!) от двете страни да стане еднакъв
- двете уравнения се умножават така, че броят електрони да е еднакъв
- двете полуреакции се събират (електроните от двете страни се унищожават, защото са по равен брой от двете страни)
- извършват се нужните математически операции, така че всяко вещество да се среща само от една страна на уравнението
- само когато средата е основна (както е в този случай), ако има останали водородни положителни йони, към двете страни на уравнението се добавят хидроксидни йони, които да ги неутрализират до вода
-
Ред на относителната активност
а) на метали
- по-активен метал -> по-добър редуктор (по-лесно отдава елекрони)
- йон на по-активен метал -> по-слаб редуктор (по-трудно отдава електрони)
-
Галваничен елемент - устройство, което превръщащо химична енергия в електрична
а) механизъм на действие - при окислително-редукционните процеси се обменят електрони, които могат да се движат и по проводници
-
Галваничен елемент на Даниел-Якоби
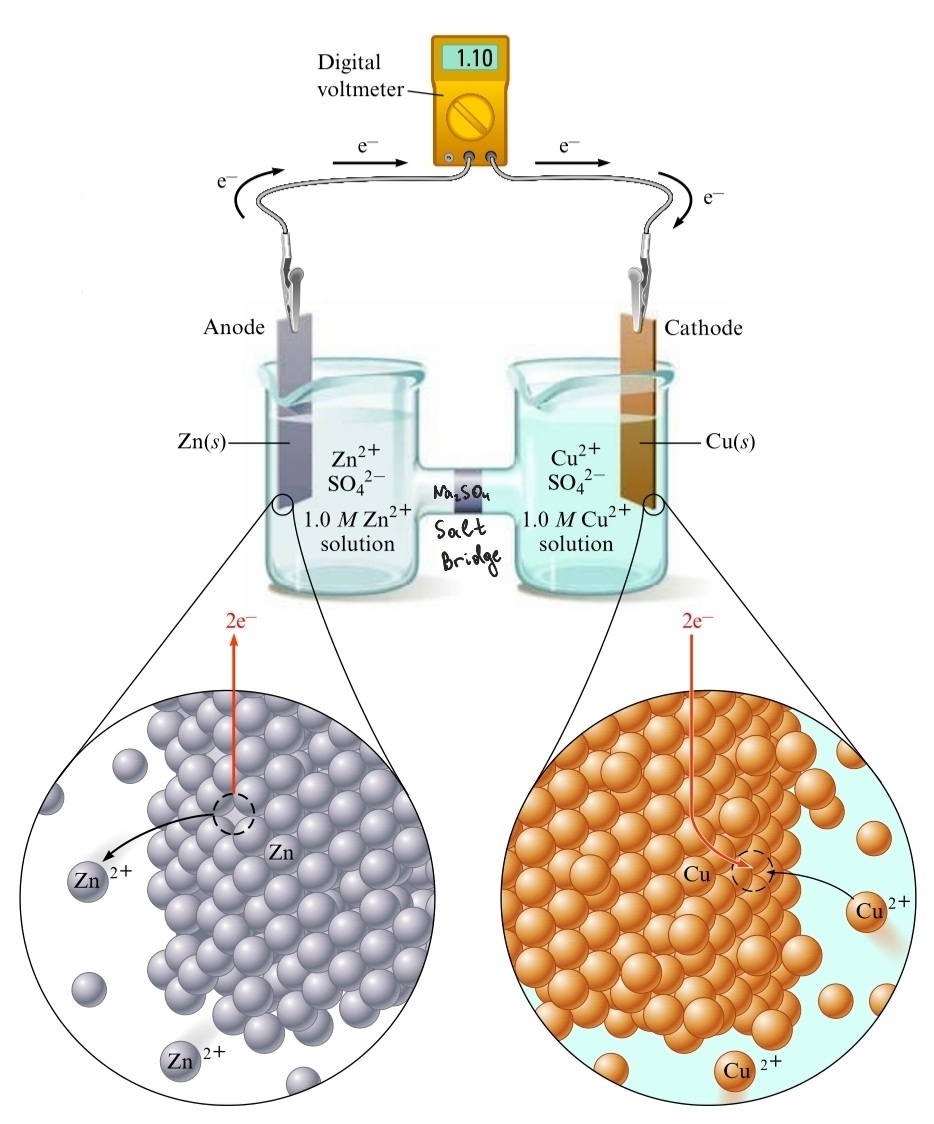
а) електрод - пластина, на която се случва една от полуреакциите на ОРП
- анод - електродът, върху който протича окислението (отдават се електрони)
- катод - електродът, върху който протича редукцията (приемат се електрони)
б) солеви мост - тръба, съдържаща неутрален за системата електролит, чиито йони служат за уравновесяването на зарядите в двата електрода
в) механизъм на действие
- приготвят се два разтвора на соли на веществата, участващи в галваничния елемент ( и )
- в разтворите се поставят твърди пластинки от съответните прости вещества
- цинковата пластинка започва да се разтваря в разтвора, като цинковите атоми се превръщат в цинкови йони, отделяйки два електрона, които тръгват нагоре по проводника
- електроните стигат до медната пластинка, където привличат медни йони върху повърхността ѝ и се сливат с тях, образувайки медни атоми
- в първия разтвор се увеличават положителните заряди (), които привличат отрицателни йони от солевия мост, за да се уравновеси балансът; в противен случай допълнителноте положителни заряди няма да позволят на електроните да тръгнат по проводника
- във втория разтвор намаляват положителните заряди () и разтворът става отрицателно зареден, привличайки положителни йони от солевия мост, който да уравновесят баланса; в противен случай отрицателният заряд няма да позволи на електроните от проводника да стигнат до разтвора
-
Галванични елементи с инертни електроди
-
Стандартен запис на галваничен елемент
- вляво се отбелязва анодното окисление, като се записват само веществата - изреждат се със запетаи, а фазовите граници се отбелязват с вертикална черта
- солевият мост се записва с две вертикални черти
- вдясно се отбелязва катодната редукция по същия начин като при окислението
-
Стандартен водороден електрод (С.В.Е.) - едномоларен разтвор () на йони при стандартна температура (), в който има пластмасова тръбичка с платинена пластинка в нея, през която тръбичка се продухва водороден газ под стандартно налягане ()
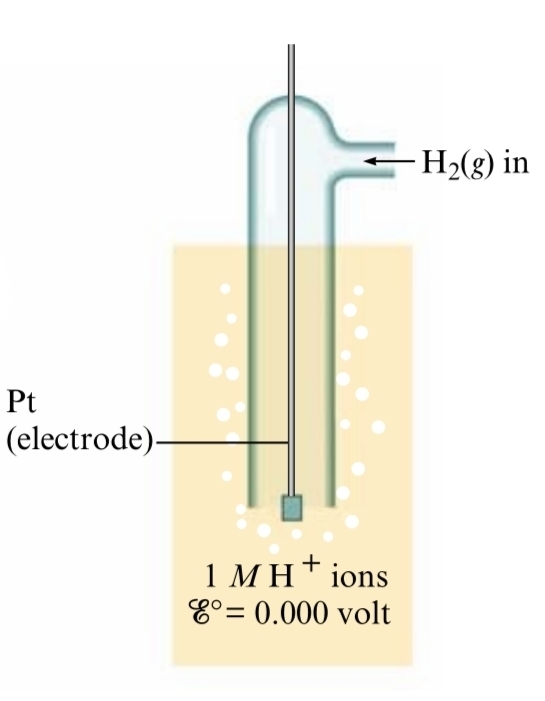
а) окислително-редукционни процеси - в зависимост от електрода, с който е свързан, С.В.Е. може бъде или анод или катод (да протича или окисление, или редукция)
-
Стандартен електроден потенциал () - потенциалната разлика, която електродът създава, когато се свърже със С.В.Е. при стандартни условия
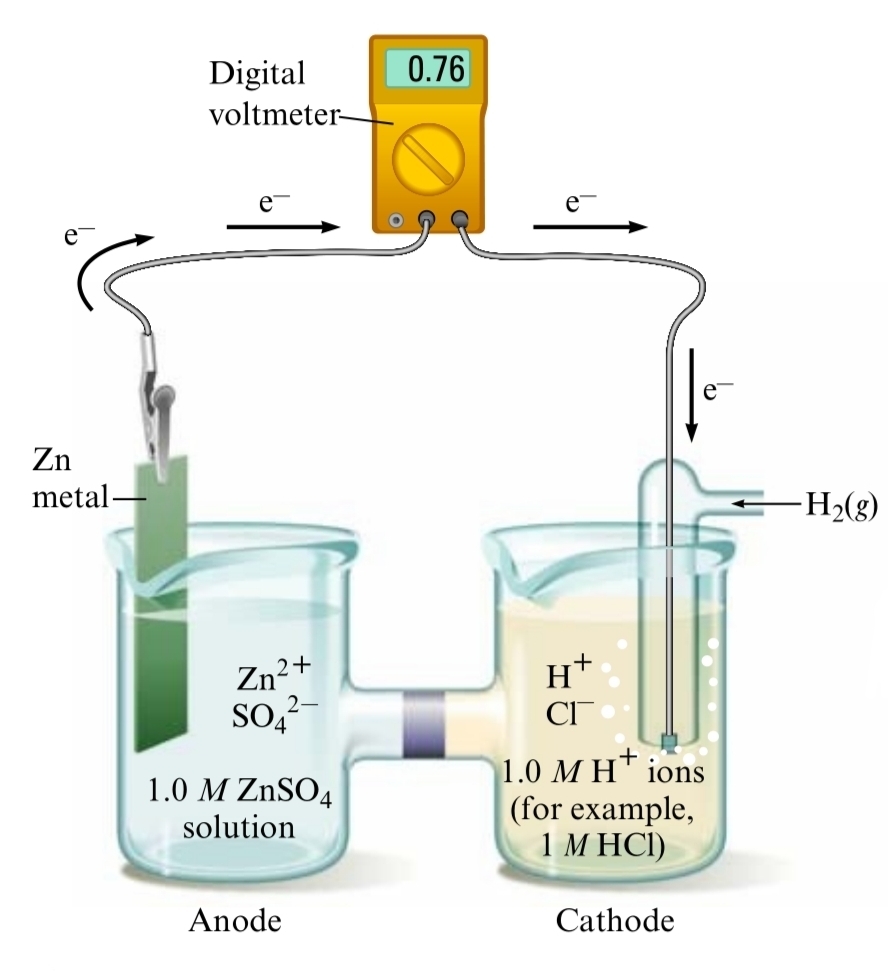
а) стандартен електроден потенциал на С.В.Е. - приема се за нула
б) свойства
- интензивна величина - не зависи от броя електрони или молове вещество, участващи в реакцията
-
Стандартен редукционен потенциал - таблична стойност, равна на стандартния електронен потенциал на редукционната полуреакция
Върху даден електрод може да се случва и окисление, и редукция в зависимост от другия електрод, с който е свързан.
Редукцията и окислението върху един и същ електрод са обратни една на друга реакции, следователно имат един и същ стандартен електроден потенциал, но с различен знак.
По конвенция е прието в таблиците да се записва стандартния електроден потенциал при редукция.
а) ред на относителна активност
- колкото по-голям е стандартният редукционен потенциал, толкова по-добър окислител е веществото, което участва в реакцията
-
Електродвижещо напрежение на галваничен елемент (ЕДН) - напрежението, което се създава между двата електрода на галваничен елемент
а) стандартно електродвижещо напрежение () - електродвижещото напрежение на галваничния елемент при стандартни условия
Изчисляване:
- записват се и се изравняват двете полуреакции
- до тях се записват стандартните редукционни напрежения, като знакът при реакцията на окисление се обръща, а стойността не се умножава спрямо моловете
- електродвижещото напрежение на галваничния елемент се пресмята по формулата
б) връзка с енергия на Гибс
- константа на Фарадей:
- брой обменени електрони:
- електродвижещо напрежение:
Спонтанност на процеса спонтанен равновесие неспонтанен в) уравнение на Нернст - за изчисляване на ЕДН при нестандартни условия
- константа на Фарадей:
- брой обменени електрони:
- концентрационно реакционно отношение:
- универсална газова константа:
- температура:
Доказателство
г) стандартен електронен потенциал и равновесна константа
-
Оловен акумулатор - състои се от шест клетки с ЕДН 2 волта, с които се печелят общо 12 волта
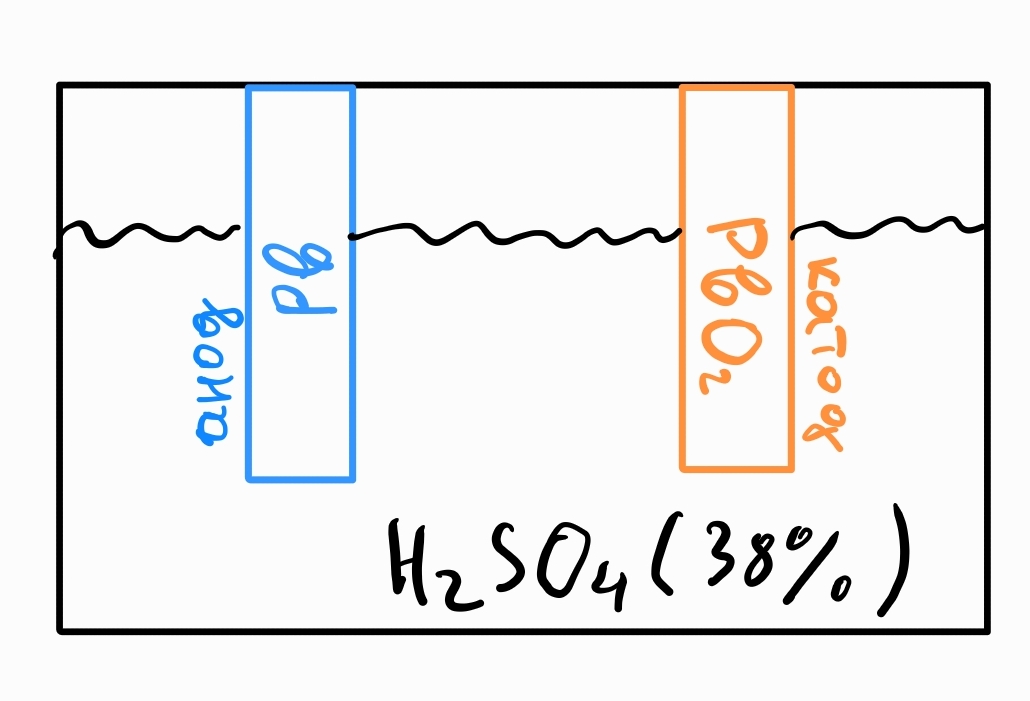
-
Сухи батерии
а) обикновена цинкова батерия
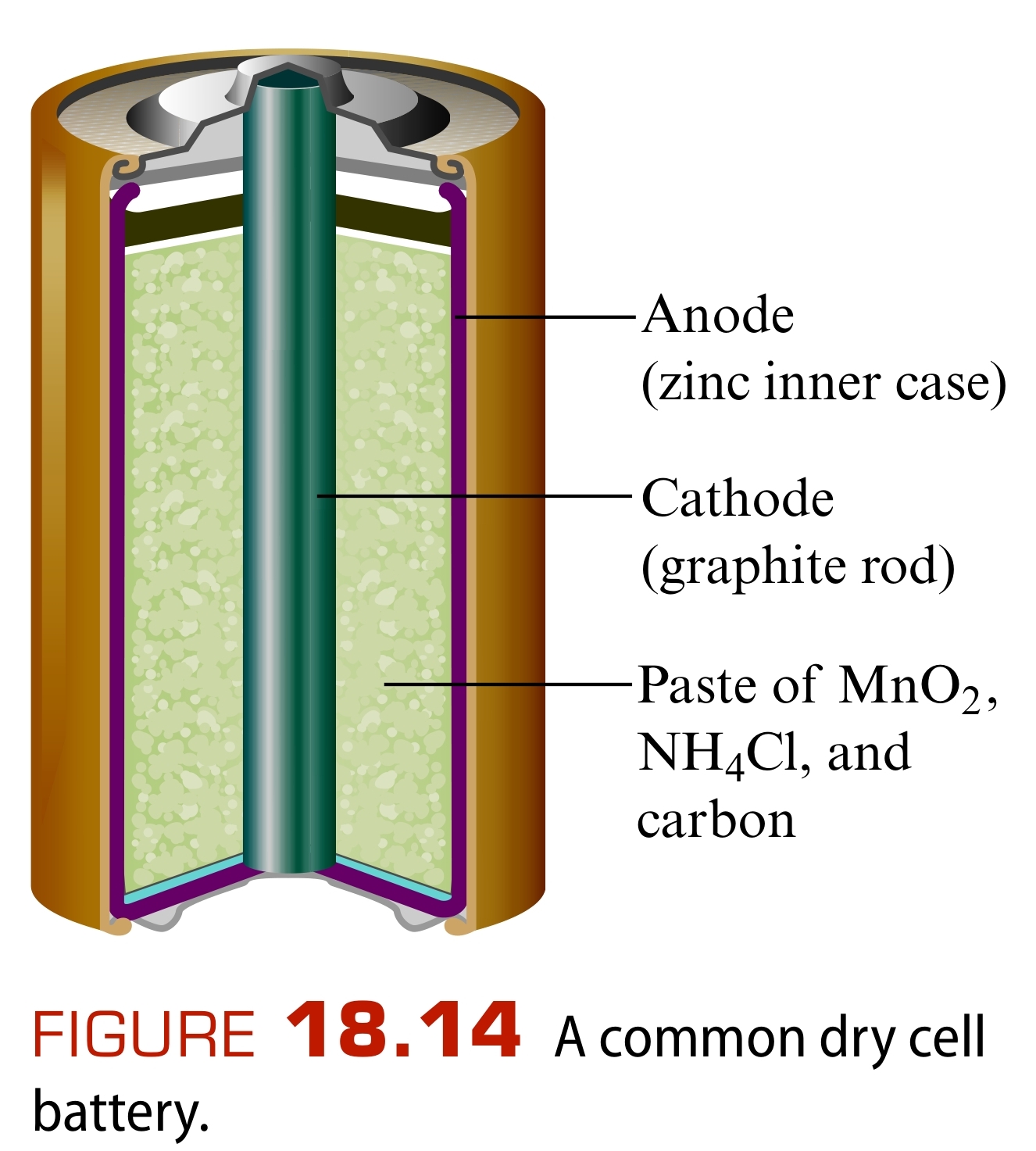
- анод - цинкова обвивка
- катод - графит
- електролитна паста - киселинна смес с и
б) обикновени алкални батерии - имат същото устройство като обикновените цинкови батерии, но електролитната паста е алкална основа, за да удължи живота на батерията
-
Корозия - процес на разрушаване на някои метали поради протичането на окислетелно-редукционни процеси между тях и околната среда
-
Корозия на желязо
а) условия - едновременно трябва да има:
- вода
- кислород
б) механизъм - формиране на множество микрогалванични елементи
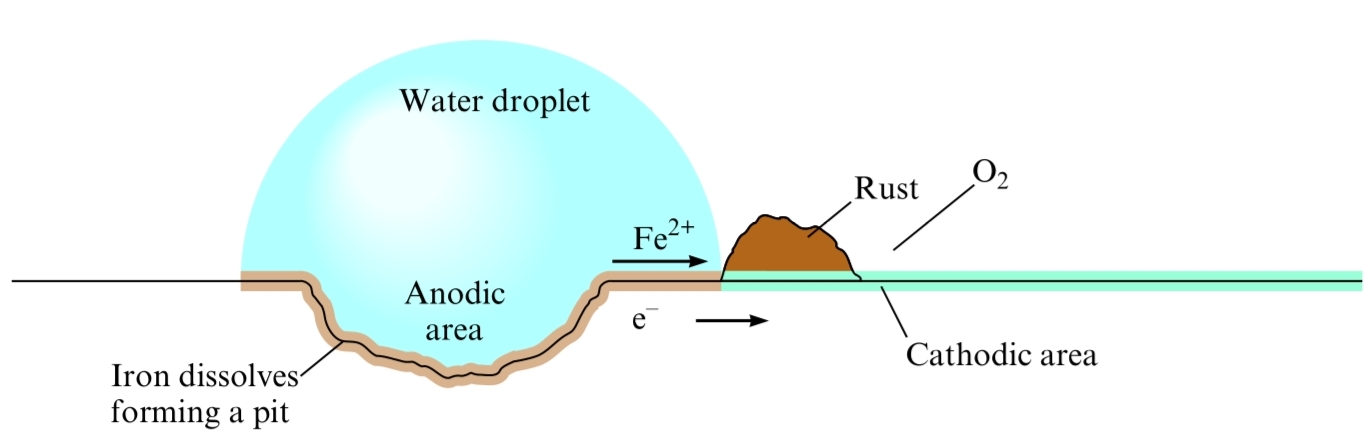
- твърдо желязо от повърхността се окислява до йони, които се разтварят във водната капка, и се формира микроанод
- на границата между водната капка и въздуха, близо до повърхността на желязото, кислородът се редуцира, образувайки мини катод
- вътре в самата капка йоните се окисляват от разтворения в нея кислород до йони, които реагират с още от разтвореноя кислород, образувайки ръжда ()
в) превенция
- боядисване с влажна боя
- галванизация - нанасяне на метално покритие на по-активен метал върху желязото, които да се окислява вместо желязото
- жертвен анод - свързване на много по-активен метал със повърхността на желязото на определени места, върху които да се случва окислението
-
Електролиза - неспонтанен окислително-редукционен процес, който протича при подаването на електрично напрежение
-
Електролизна клетка - устройство, в което под действие на електричен ток се синтезира вещество
а) електролиза в стопилка на електролит - вид електролизна клетка, при който електролизата протича в разтопен електролит
б) електролиза във воден разтвор на електроли - вид електролизна клетка, при който електролизата протича във воден разтвор на електролита
- на всеки електрод може да протече или полуреакцията, в която участва електролитът, или полуреакцията, в която участва водата
- при голяма разлика в електродния потенциал на полуреакциите, протича полуреакцията, чийто електроден потенциал е по-голям
- когато обаче разликата не голямо, трябва експериментално да се провери коя полуреакция протича
-
Електролиза на вода - метод за получаване на водород и кислород
-
Закон на Фарадей - количеството вещество, което се синтезира / изразходва на даден електрод, зависи от количеството електрони, които се обменят на този електрод
-
Скорост на измениеното в концентрацията на веществата - промяната в концентрацията на веществото за единица време
а) връзка между измененията на веществата - скоростите на изменението на веществата в една и съща реакция са различни, защото веществата участва с различни молове
-
Скорост на химична реакция - скоростта на изменението в концентрацията на кое да е вещество от реакцията, но взета за 1 мол, за да се получава едно и също число, независимо от веществото
а) средна скорост - изчислява се за сравнително дълги периоди от време
б) моментна скорост - средната скорост, но за безкрайно малък интервал от време
-
Кинетично уравнение - начин за представяне моментната скорост на дадена реакция като функция на концентрациите на изходните вещества в този момент
Всяка реакция има различно кинетично уравнение, което може да се определи само експериментално.
а) кинетична константа () - обхваща въздействието на всички фактори, които не са концентрациита на изходните вещества
- определя се експериментално
б) порядък на реакцията - определя се експериментално
- общ порядък:
- частен порядък спрямо :
- частен порядък спремо :
Частните порядъци много рядко съвпадат със стехиометричните коефициенти пред продуктите, като това става предимно в много прости реакции.
в) метод на началните скорости - експериментален метод за определяне на кинетичното уравнение на дадена реакция
- правят се няколко експеримента, като се варират началните концентрации на изходните вещества
- измерва се моментната скорост точно след началото на реакцията
- резултатите се сравняват, за да се определят частните порядъци
- накрая се пресмята кинетичната константа
-
Кинетичен закон - позволява да се намерят концентрациите на изходните вещества в определен момент след започването на реакцията
-
Кинетика на реакции от нулев порядък с едно изходно вещество - скоростта не зависи от концентрацията на изходните вещества
а) интегрална форма на кинетичния закон - дава концентрацията на изходното вещество след време , ако началната му концентрация е
Доказателство
б) линеализиращ мащаб
в) период на полуразпад () - времето, за което концентрацията на изходното вещество ще се намали наполовина
Доказателство
-
Кинетика на реакции от първи порядък с едно изходно вещество
а) интегрална форма на кинетичния закон - дава концентрацията на изходното вещество след време , ако началната му концентрация е
Доказателство
б) линеализиращ мащаб
в) период на полуразпад () - времето, за което концентрацията на изходното вещество ще се намали наполовина
Доказателство
-
Кинетика на реакции от втори порядък с едно изходно вещество
а) интегрална форма на кинетичния закон - дава концентрацията на изходното вещество след време , ако началната му концентрация е
Доказателство
б) линеализиращ мащаб
в) период на полуразпад () - времето, за което концентрацията на изходното вещество ще се намали наполовина
Доказателство
-
Теория на ефективните удари - химична реакция протича, когато се сблъскат частици с определена минимална енергия и правилно пространствено ориентиране
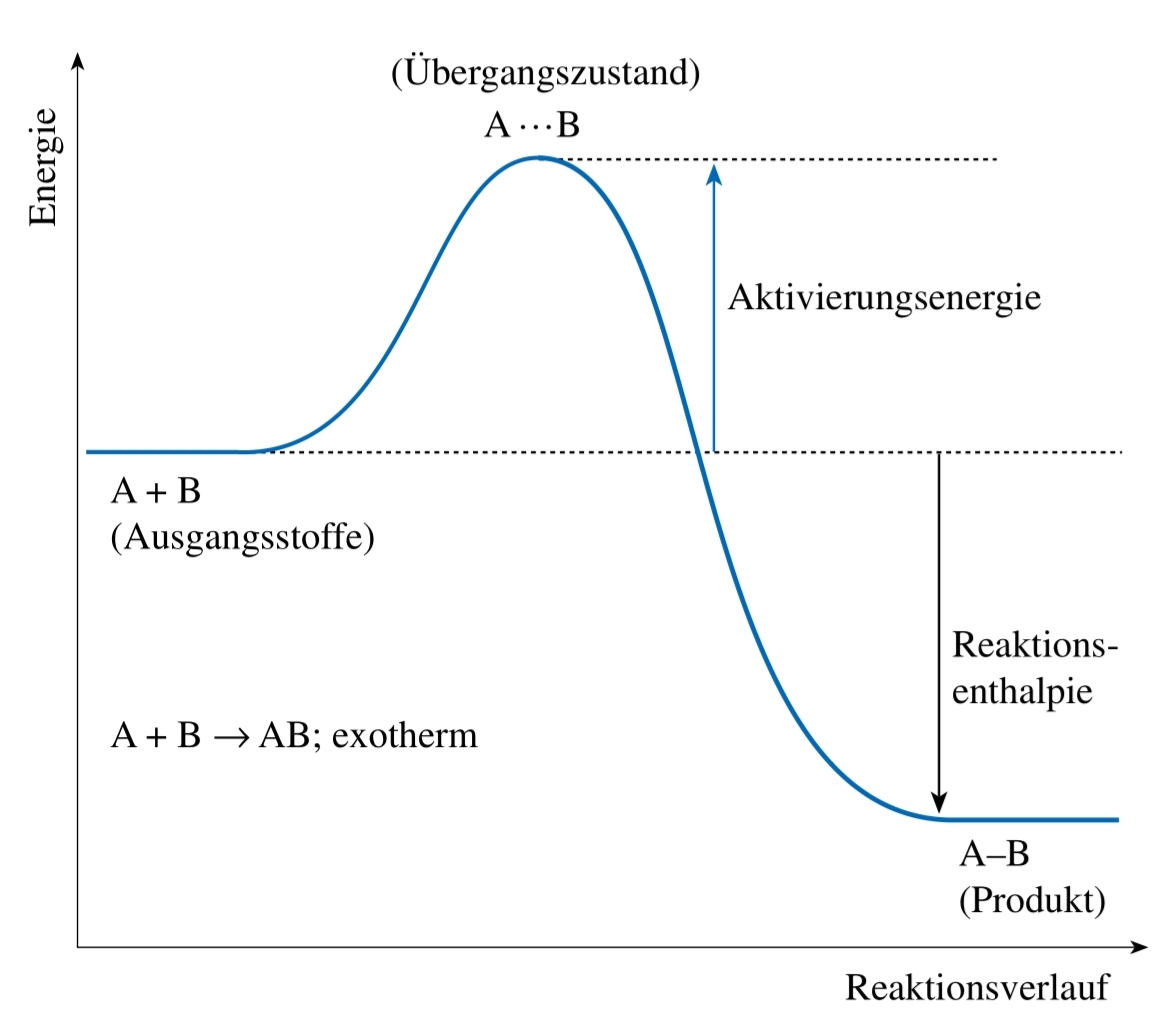
а) активираща енергия - минималното количество енергия, която частиците трябва да имат, за да бъде ударът "ефективен" (да протече реакция)
б) част от частиците, притежаващи енергия
в) стеричен фактор () - показва частта от частиците с правилна ориентация
г) честота на ударите () - показва честотата на всички удари
-
Механизъм на химична реакция - последователността от етапи, през които преминава дадена химична реакция
а) етап (елементарна реакция) - показва реално химично взаимодействие, което се случва по време на реакцията
- молекулност - броят молекули, участващи едновременно в ефективния удар (елементарния акт на реакцията)
Вид реакция Описание Пример мономолекулна участва една частица (спонтанно разпадане) бимолекулна участват две частици тримолекулна участват три частици (най-често третата частица не участва в продукта, а просто дава нужната енергия, за да се свържат другите две частици) - порядък - общият порядък съвпада с молекулността на реакцията и може да се изведе директно от стехиометричните коефициенти
б) обща реакция - сума от елементарните реакции
- показва само общата стехиометрия на химичната реакция
- реакционен интермедиат - вещество, което се получава и изразходва в етапите, така че да не се проявява като краен продукт
-
Кинетика на последователни реакции - скоростта на реакцията зависи от най-бавния етап
а) реакции с първи скоростоопределящ етап - първият етап е най-бавен
- кинетичното уравнение на общата реакция е кинетичното уравнение на първият (най-бавният) етап
б) реакции с непърви скоростоопределящ етап - най-бавният етап не е първи
- ако кинетичнато уравнение на скоростоопределящия етап зависи от концентрацията на някои интермедиат, се търси връзка между тази концентрацията и някоя концентрация, която може да се намери
Пример:
Приемаме, че първият етап е в равновесие. Тогава
-
Емпирично правило на Вант-Хоф - при всяко покачване на температурата с 10°С скоростта скача 2-4 пъти
а) обяснение - покачването на температурата покачва кинетичната енергия на частиците и се случват повече ефективни удари
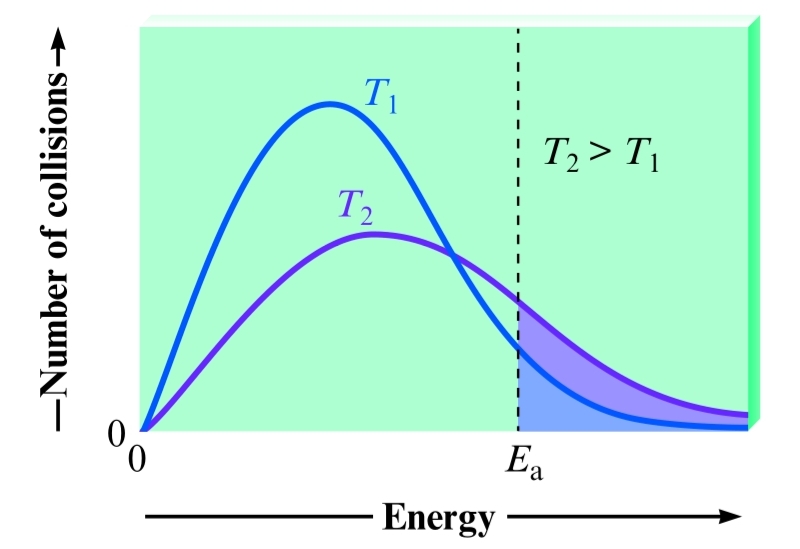
-
Уравнение на Арениус - изразява зависимостта на скоростната константа от температурата, общия брой удари и броя ефективни удари с правилна ориентация
а) честотен множител
-
Катализа - начин за промяна на скоростта на химичните реакции чрез влияние върху активиращата енергия
а) катализатор - вещества, увеличаващи скоростта на реакцията
- остава непроменен в края на процеса
б) инхибитор - вещества, забавящи реакцията
- остава непроменен в края на процеса
-
Видове катализа
а) хомогенна катализа - изходните вещества и катализаторът образуват една фаза
- механизъм на катализата - образуват се интермедиати, които много по-лесно взаимодействат с по-ниска активираща енергия
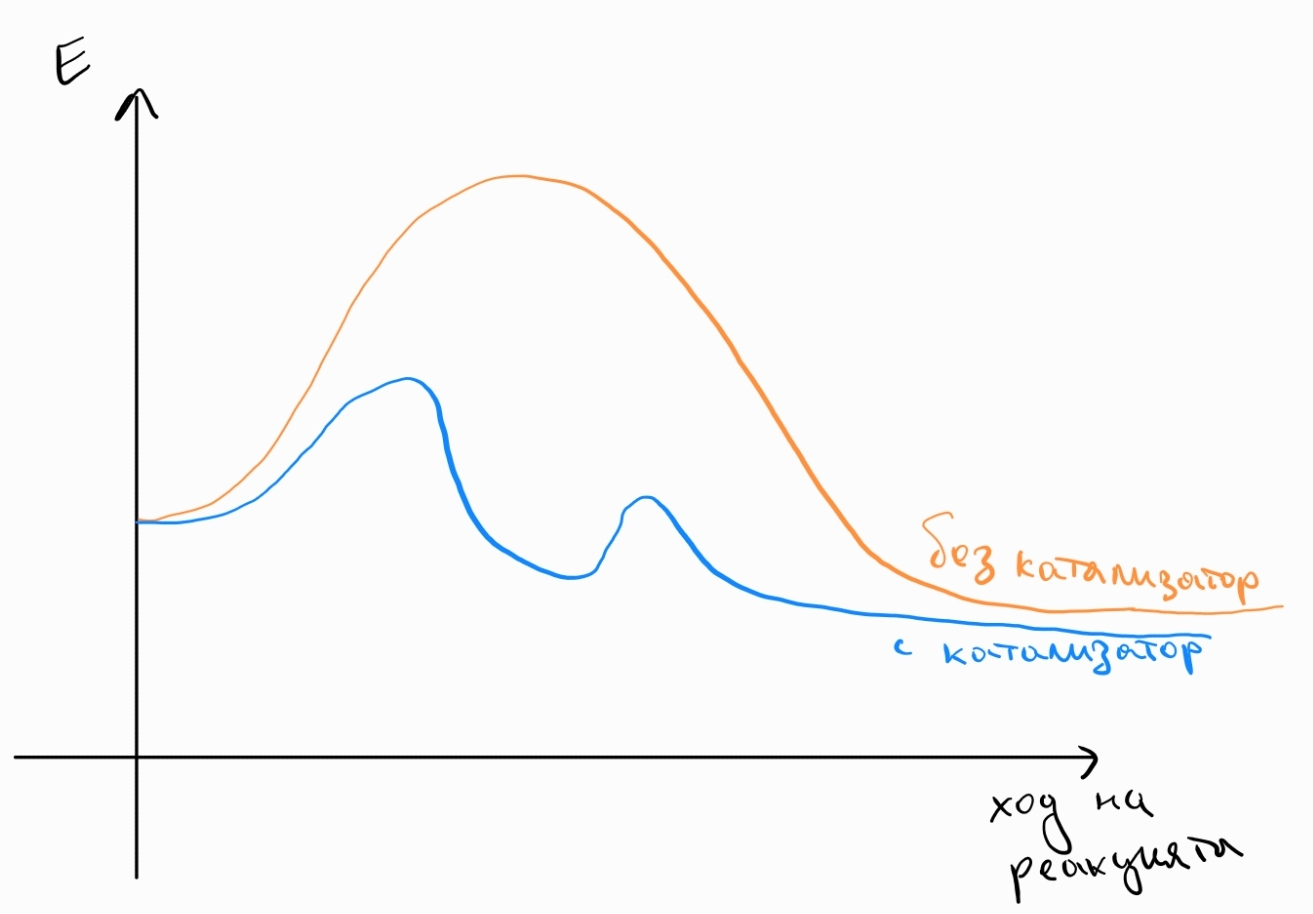
Добавянето на катализатор кара елементарната реакция да протича на два етапа.
- скоростта е правопропорционална на концентрацията на катализатора
б) хетерогенна катализа - между изходните вещества и катализатора има фазова граница (предимно твърд катализатор и газообразни изходни вещества)
- механизъм на катализата - върху повърхността на катализатора възниква адсорбция на частиците на изходните вещества, което кара старите връзки да отслабнат и по-лесно да се разкъсат
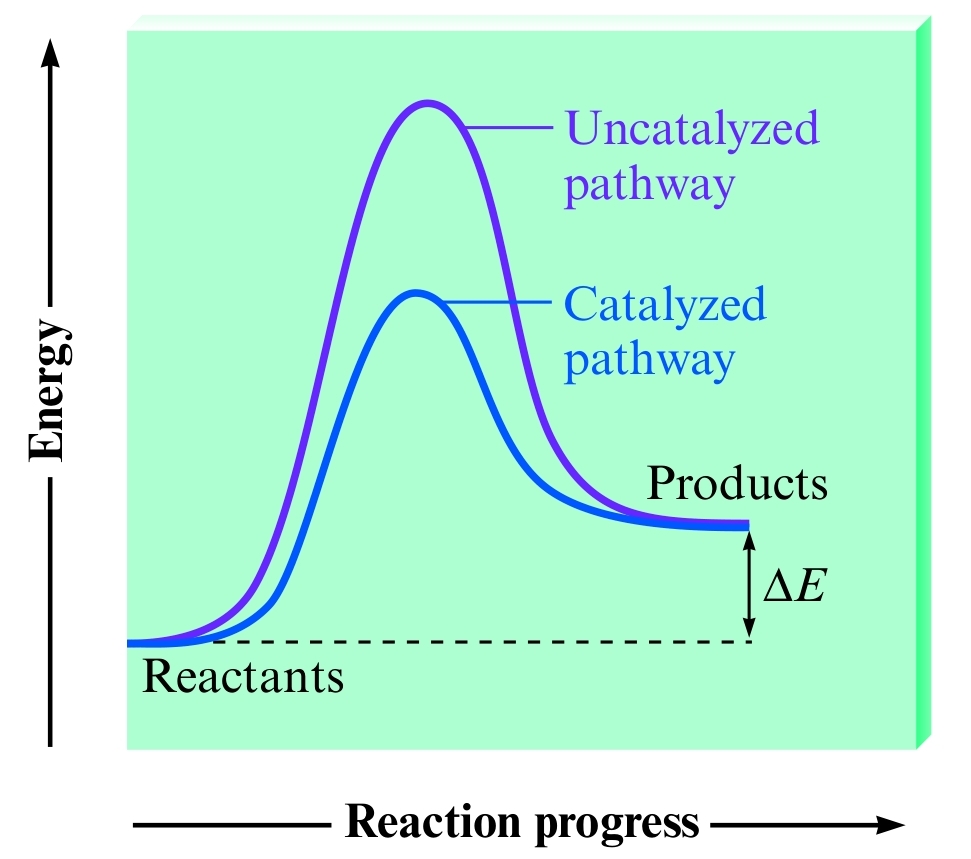
-
Кинетика на каталитичните реакции
а) при хомогенна катализа
- кинетична схема на Брьонстед-Биерум
- ако скоростоопределящият етап е първият:
- ако скоростоопределящият етап е вторият:
Доказателство
метод на стационарната концентрация - колкото количество интермедиат се получава от катализатора в един етап, толкова се изразходва в другия етап ()
-
Ензимна катализа
-
Комплексно съединение - съединение, съставено от централен метален атом (или йон), свързан с група молекули (или йони) чрез връзки по донорно-акцепторен механизъм
-
Строеж на комплексните съединения според теорията на Вернер
а) комплексообразувател - централният метален атом (или йон)
- съдържа празни атомни орбитали - играе ролята на акцептор
- координационно число - показва броя на лигандите, свързани с комплексообразувателя
Координационно число Геометрия Пример 2 линейна геометрия
4 тетраедрична геометрия
4 квадратно-планарна геометрия
6 октаедрична геометрия
б) лиганди - частиците, свързани с комплексообразувателя
- съдържат неподелени електронни двойки - играят ролята на донори
- неутрален лиганд - лигандът няма електричен заряд (молекула)
- зареден лиганд - лигандът има електричен заряд (йон)
- монолиганд - лигандът има само една неподелена електронна двойка
- полилиганд - лигандът има повече от една неподелени електронни двойки, които принадлежлат на различни атоми
в) видове комплексни съединения според заряда
- неутрални
- анионни
- катионни
-
Запис и номенклатура на комплексни съединения
а) химичен запис
- формулата се поставя в квадратни скоби
- като първи се записва комплексообразувателя
- след комплексообразувателя се записват лигандите, като се поставят в нормални скоби, ако са сложни частици, а като индекс се записва броят им
- записва се и зарядът на цялото комплексно съединение
Пример
б) номенклатура
- първо се изреждат всички лиганди по азбучен ред
- пред всеки лиганд като представка от типа ди-, три-, тетра- и т.н. се записва броят на този вид лиганд (ако наименованието на самия лиганд съдържа такава представка, то представката пред лиганда се превръща в бис-, трис-, тетрис- и т.н.)
- ако лигандът е неутрален, не се поставя окончание след наименованието му
- за неутралните лиганди се използват съответно наименованията "аква", "амин", "карбонил"
- ако лигандът е анион, към латинското му наименование се добавя "-о"
Наименования на анионни лиганди
Лиганд Наименование флуоридо- хлоридо- хидроксидо- цианидо- азидо- имидо- хидридо- оксидо- пероксидо- сулфидо- сулфанидо- нитрито- нитрато- сулфато- - записва се името на комплексообразувателя - ако комплексното съединение е неутрално или катион, наименованието на комплексообразувателя остава непроменено, но ако е анион, се използва латинското наименование с наставка "-ат"
- записва се с римски цифри степента на окисление на комплексообразувателя
Примери
-
Координационно съединение - съединение на комплексен йон с противойон чрез йонна връзка
а) координационна сфера
- вътрешна - комплексното съединение
- външна - другото съединение
-
Запис и номенклатура на координационни съединения
а) химичен запис
- първо се записва катиона
- после се записва аниона
б) номенклатура
- ако е анион, комплексното съединение си се записва със своето наименование
- ако е катион, към наименованието на комплексното съединение се добавя наставка "-ов" / "-ев"
-
Изомери - съединение с еднакъв качествен и количествен състав, но различен строеж
-
Cis-trans изомерия на комплексни съединения - изомерите се отличават по това дали еднаквите лигандите са разположени един до друг или един срещу друг
а) в квадратно-планарни комплекси ()
- cis-изомер - еднаквите лиганди са разположени един до друг (90°)
- trans-изомер - еднаквите лиганди са разположени един срещу друг (180°)
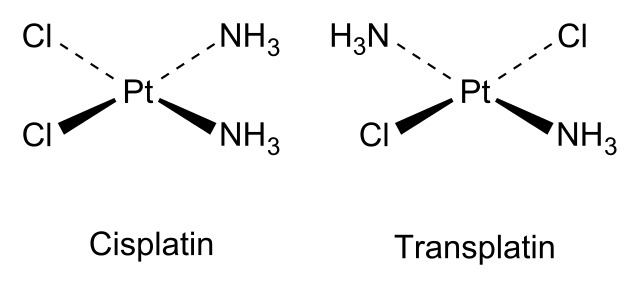
б) в октаедрични комплекси ( или )
- cis-изомер - ъгълът между еднаквите лиганди е 90°
- trans-изомер - ъгълът между еднаквите лиганди е 180°
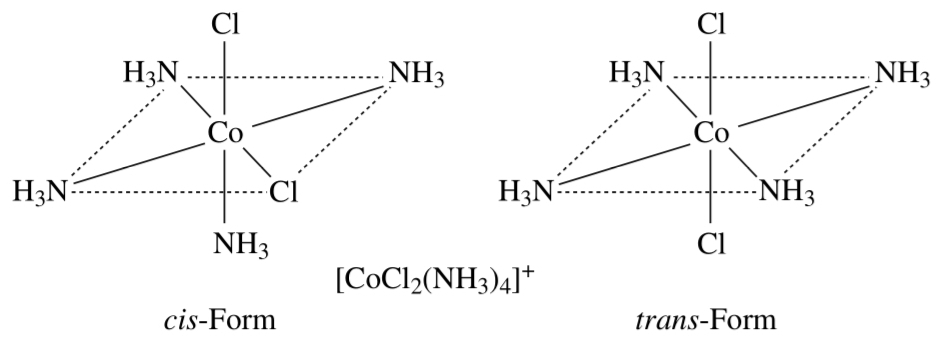
-
Енантиомерия - изомерия на хирални съединения, които са огледални образи един на друг
а) хирално съединение - съединение, което не може да се раздели от равнина на симетрия
б) различаване на енантиомери
- по посоката, в която завъртат плоско поляризирана светлина
- по активността в реакции с други хирално съединения
-
Структурна изомерия на координационни съединения
а) изомери при свързване - външната сфера е свързана с различна част на комплексното съединение
б) йонизационна изомерия - изомерите се различават по вида на йона, свързан с комплексното съединение
-
Метод на валентните връзки - химичните връзки се осъществяват чрез припокриване на атомни орбитали с неподелени електронни двойки от лигандите и празни атомни орбитали от комплексообразувателя
а) хибридизация на орбиталите на комплексообразувателя
Координационно число / Геометрия Хибридизация 2 4 (тетраедрична) 4 (квадратно-планарна) 6 или -
Теория на кристалното поле - химичните връзки в комплексните съединения са йонни и се осъществяват чрез електростатично взаимодействие между комплексообразувателя и лигандите
а) тетраедрично поле - между лигандите и електроните в орбиталите на комплексообразувателя възникват сили на отблъскване, които разцепват енергийните нива на комплексообразувателя, изблъсквайки орбиталите на по-висока енергия от орбиталите
б) октаедрично поле - между лигандите и електроните в орбиталите на комплексообразувателя възникват сили на отблъскване, които разцепват енергийните нива на комплексообразувателя, изблъсквайки орбиталите на по-ниска енергия от орбиталите
в) сила на полето
- параметър на разцепване () - разликата в енергията на разцепените орбитали
- слабо поле - лигандите не карат електроните на комплексообразувателя да се сдвоят до възможно най-ниско енергийно ниво (малък параметър на разцепване)
- силно поле - лигандите карат електроните на комплексообразувателя да се сдвоят до възможно най-ниско енергийно ниво (голям параметър на разцепване)
Дали един лиганд създава силно или слабо поле се показва от спектрохимичния ред. Лигандите преди водата (включително) създават слабо поле, а тези след нея - силно.
-
Цвят на комплексните съединения - зависи от вида на комплексообразувателя и лигандите
а) механизъм - при преминаване на електрон от по-ниско в по-високо енергийно ниво се поглъща фотон с дължина на вълната, съответстваща на разликата в енергиите на двете състояния
-
Образуване на комплексните съединения - става на етапи
а) степенна стабилитетна константа - всеки етап се характеризира с равновесна константа
-
Стабилитетна константа - равновесната константа на общото уравнение
а) връзка със степенните равновесни константи
-
Кои са активните метали?
а) алкални метали -
- 1 (IA) група
- електронна конфигурация: (-елементи)
- най-ясно изразено подобие в свойствата
- образуват само йонни връзки под формата на йони
б) магнезий -
- 2 (IIA) група, 3. период
- електронна конфигурация:
- не е пълен електронен аналог на другите елементи от групата
- образува само йонни връзки под формата на йони
- с по-умерена химична активност от алкалните метали
в) алкалоземни метали -
- по-слабо активни от алкалните метали
- електронна конфигурация:
- пълни електронни аналози един на друг
- образуват само йонни връзки под формата на йони
г) алуминий -
- 13 (IIIA) група, 3. период
- електронна конфигурация:
- образува предимно ковалентни връзки
- постоянна степен на окисление +III
- добър комплексообразувател
-
Разпространение - в природата се срещат само в съединения
Метал Съединения (минерали, руди) (халит), (чилска селитра), (силвинит) (силвин), (силвинит) (магнезит), (доломит) (варовик, мрамор, креда) (боксит, корунд), (хидраргилит) Йоните на са широко разпространени и в морската вода.
-
Производството
а) на металите - чрез електролиза в клетка на Даунс
- суровини - морска вода, минала през фракционна кристализация
б) на магнезий
- суровини - морска вода
- етап I: варуване на морска вода - обработване на морската вода с гасена вар
Полученият магнезиев хидроксид се филтрува.
- етап II: Разтваряне на утайката в солна киселина
-
Алкални метали -
-
Физични свойства
- сребристобял цвят (само цезият е златист)
- метален блясък
- меки и леки
- ниска температура на топене
- висока топло- и електропроводимост
- най-активните метали
- съхраняват се в инертна среда
-
Кислородосъдържащи съединения
а) видове
- оксиди - съдържат оксидни () йони
- пероксиди - съдържат пероксидни () йони
- супероксиди - съдържат супероксидни () йони
б) получаване
- горене на алкален метал на въздух
- горене на алкален метал в чист кислород
- стапяне на метала с негово съединение - за получаване на алкални оксиди
в) химични свойства
- на оксидите
Взаимодействие Продукти Пример с вода хидроксид с киселини сол и вода с киселинни оксиди сол - на пероксидите
Взаимодействие Продукти Реакция с вода основа и водороден пероксид с киселина сол и водороден пероксид г) употреба - нямат значителна промишлена употреба
-
Хидроксиди ()
а) получаване
Реагенти Продукти Реакция алкален метал + алкален хидроксид + алкален оксид + алкален хидроксид алкален пероксид + алкален хидроксид + алкален супероксид + алкален хидроксид + - хлоро-алкална електролиза
б) химични свойства - силно основни
- огромна разтворимост във вода
Взаимодействие Продукти Реакция с киселини сол и вода в) употреба
- (сода каустик) - производство на сапуни, лекарства, отпушване на канали
-
Карбонати () и хидрогенкарбонати ()
а) получаване
- на карбонати
Реагенти Продукти Реакция алкален оксид + карбонат алкален пероксид + карбонат + алкален хидроксид + карбонат + алкален хидрогенкарбонат карбонат + - на хидрогенкарбонати
Реагенти Продукти Реакция алкален карбонат + хидрогенкарбонат разтвор на алкална основа + хидрогенкарбонат б) химични свойства
- на карбонатите - основни
Взаимодействие Продукти Реакция със силна киселина ("шумяща проба") сол,
- на хидрогенкарбонатите
Взаимодействие Продукти Реакция термично разлагане карбонат, в) приложение
- (калцинирана сода) - производство на стъкло, хартия, сапуни
- (сода бикарбонат) - в кулинарията
-
Халогениди
а) получаване
- директно взаимодействие
- взаимодействие с халогеноводород
- чрез обменна реакция между алкален карбонат и халогеноводород
- чрез обменна реакция между алкален хидроксид и халогеноводород
б) химични свойства - соли с йонно-кристален строеж, често под формата на кристалохидрати
в) приложение
- (готварска сол) - хранително-вкусова промишленост, производство на
-
Хидриди
а) получаване - директно взаимодействие между алкален метал и водород
б) химични свойства - изключително силни основни свойства заради хидридния () йон
Взаимодействие Продукти Реакция с вода алкална основа и водород в) приложение
- бърз и лесен начин за получаване на водород
- надуваеми спасителни жилетки
- ракетно гориво
-
Алкалоземни метали -
-
Физични свойства
- сребристобял цвят
- метален блясък
- висока топло- и електропроводимост
- ковки и разтегливи при нагряване
- съхраняват се в инертна среда
-
Кислородосъдържащи съединения
а) видове
- оксиди - съдържат оксидни () йони
- пероксиди - съдържат пероксидни () йони
б) получаване
- на оксиди
Реагенти Продукти Реакция алкалоземен карбонат алкалоземен оксид + (печене на карбонати) - на пероксиди
Реагенти Продукти Реакция алкалоземен пероксид в) химични свойства
- на оксидите
Взаимодействие Продукти Пример с вода хидроксид с киселини сол и вода с киселинни оксиди сол - на пероксидите - много силно привличат водородни йони
Взаимодействие Продукти Реакция с вода основа и водороден пероксид с киселина сол и водороден пероксид г) употреба
- (негасена вар) - обезводняващ реагент, извличане на магнезиеви йони от морската вода, строителство
-
Хидроксиди
а) получаване
Реагенти Продукти Реакция алкалоземен метал + алкалоземен хидроксид + алкалоземен оксид + алколоземен хидроксид б) химични свойства - силни основи
- ограничена разтворимост във вода
в) употреба
- (гасена вар) - умерена разтворимост във вода (), дезинфекция, варуване на почви, строителство (втвърдяване на коросан)
-
Карбонати () и хидрогенкарбонати ()
а) получаване
- на карбонати
Реагенти Продукти Реакция алкалоземен оксид + алкалоземен карбонат алкалоземен хидроксид + алкалоземен карбонат + - на хидрогенкарбонати
Реагенти Продукти Реакция алкалоземен карбонат + алкалоземен хидроген карбонат б) химични свойства
- на карбонатите - неразтворими във вода
- на хидрогенкарбонатие - амфотерни
Реагенти Продукти Реакция алкалоземен хидрогенкарбонат алкалоземен карбонат + термично разлагане: в) приложение
- (варовик) - съдържа се в костите и органични черупки, пещерни образувания, изгражда котления камък
-
Халогениди
а) получаване
Реагенти Продукти Реакция алкалоземен метал + халоген алкалоземен халогенид алкалоземен метал + халогеноводород алкалоземен халогенид + алкалоземен карбонат + халогеноводород алкалоземен халогенид + алкалоземен хидроксид + халогеноводород алкалоземен халогенид + б) химични свойства - соли с йонно-кристален строеж, често под форматя на кристалохидрати
в) приложение
- - силно хигроскопично съединение; използва се за извличане на вода от газове и течности; ръси се по улиците, за да предоврати заледяване
- - червен цвят на фойерверките
-
Хидриди
а) получаване - директно взаимодействие между алкален метал и водород
б) химични свойства - изключително силни основни свойства заради хидридния () йон
Взаимодействие Продукти Реакция с вода алкалоземен хидроксид и водород в) приложение
-
Физични свойства
- сребристобял цвят
- метален блясък
- висока топло- и електропроводимост
- ковки и разтегливи при нагряване
- пасивира се - при излагане на въздух веднага се покрива с оксидокарбонатен слой, който пречи на чистия метал да реагира
-
Кислородосъдържащи съединения
а) видове
- магнезиев оксид - съдържа оксиден () йон
- магнезиев пероксид - съдържа пероксиден () йон
б) получаване
- горене на магнезий на въздух
- термично разлагане (печене) на магнезиев карбонат
в) химични свойства
- на магнезиевия оксид
Взаимодействие Продукти Пример с вода хидроксид с киселини сол и вода с киселинни оксиди сол -
Магнезиев дихидроксид ()
а) получаване - чрез утаечни реакции на разтворими във вода магнезиеви соли
б) химични свойства
- ограничена разтворимост във вода ()
в) употреба
- магнезиево мляко (суспензия на и вода) - лекарство против киселини
-
Магнезиев карбонат и хидрогенкарбонат
а) получаване
- на магнезиев карбонат - от разтворима във вода магнезиева сол и натриев хидрогенкарбонат
- на магнезиев хидрогенкарбонат - от магнезиев хидроксид и въглероден диоксид
-
Халогениди
а) получаване - като при алкалоземните халогениди
Реагенти Продукти Реакция + халоген алкалоземен халогенид + халогеноводород алкалоземен халогенид + + халогеноводород алкалоземен халогенид + + халогеноводород алкалоземен халогенид +
-
Физични свойства
- сребристобял
- ковък, изтеглив
- много добър електропроводник
- пасивира се - при излагане на въздух се покрива със слой от , който пречи на чистия метал да реагира по-нататък
-
Кислородосъдържащи съединения
а) видове
- алуминиев оксид - съдържа оксиден () йон
- диалуминиев триоксид - съдържа оксидни () йони
б) получаване
- термично разлагане на
- горене на алуминий на въздух
в) химични свойства
- на - амфотерни
Взаимодействие Продукти Реакция с основи комплексни съединения в разтвор:
в стопилка:с киселини г) употреба
- (корунд) - второто по твърдост естествено вещество след диаманта, изгражда скъпоценните камъни
-
Алуминиев трихидроксид ()
а) получаване
Продукти Реагенти Реакция - чрез утаечни реакции на разтворими във вода алуминиеви соли
б) химични свойства - амфотерни
- практически неразтворим във вода () - бяла утайка
- разтворим в киселини и основи
в) употреба
- пихтиеста утайка с абсорбиращи способности
- нанасяне на багрила върху дрехи
- пречистване на вода
-
Алуминият не образува карбонати и хидрогенкарбонати
-
Халогениди
а) получаване
Реагенти Продукти Реакция + халоген алуминиев халогенид + халогеноводород алуминиев халогенид + + халогеноводород алуминиев халогенид + б) химични свойства
- строеж - алуминиевите халогениди са Люисови киселини, изградени от ковалентни връзки, които формират димери в газообразно състояние
в) приложение
- - катализатор в органичната химия
-
Алуминиев трихидрид
а) получаване - косвено получаване
б) химични свойства - ковалентно съединение
в) приложение
- няма особено приложение
-
Място в периодичната таблица
- I период, 1. (IA) група
- малък атомен радиус
- висока йонизационна енергия
- може и да приема, и да отдава електрони
- йони - и
- образува и ковалентни (+I), и йонни съединения (-I)
- съществува като смес от три изотопа - протий (, деутерий () и тритий ()
-
Физични характеристики
а) разпространение
- най-разпространеният елемент във Вселената
- много слабо разпространен като чисто вещество на Земята
б) физични свойства
- просто вещество под формата на двуатомни молекули
- безцветен газ
- без вкус и без миризма
- много ниски темпедатура на втечняване и топене
-
Получаване
- изгаряне на нефт и природен газ
Реагенти Продукти Реакция конверсия на метан с прегрята водна пара (основен начин): алкан ненаситени въглеводороди + крекинг на алкални: електролиза на вода: хлоро-алкална електролиза: активен метал + киселина метални йони + активен метал + хидроксид + въглища + газификация на въглища: алкален / алкалоземен хидрид + -
Химични свойства - инертен при нормални условия
а) взаимодействия с прости вещества
Взаимодействие Продукти Реакция с активни метали йонни хидриди с преходни метали металообразни хидриди абсорбиране на в кристалната решетка с неметали ковалентни съединения б) взаимодействия с химични съединения
Взаимодействие Продукти Реакция с метални оксиди чист метал + -
Употреба
- производство на амоняк
- хидриране на органични съединения
- производство на метанол
- получаване на воден газ
- висококалорично и екологично гориво
-
Атомни характеристики
- II период, 16. (VIA) група
- много високи йонизационни стойности
- втората най-висока електроотрицателност
- образува отрицателен (оксиден) йон
- постоянна +II степен на окисление
- много добър окислител
- висока химическа активност
-
Физични свойства
а) разпространение
- на първо място по разпространение в земната кора
- образува две алотропни форми - (кислород) и (озон)
- изгражда водата и организмите
б) физични свойства
- безцветен газ
- без цвят и мирис
- по-тежък от въздуха
- ниски температури на втечняване и на замръзване
- умерена разтвотимост във вода
- парамагнитни свойства
в) получаване
- фракционна дестилация на въздуха
- термично разлагане на метални оксиди и пероксиди
- термично разлагане на алкални нитрати
Реагенти Продукти Реакция -
Химични свойства - висока реактивоспособност при нагряване
а) взаимодействия с прости вещества - не реагира само с халогените и инертните газове
- най-често се получават оксиди
Взаимодействие Продукти Реакция б) взаимодействие с химични съединения - реакции на оксиление
- характерно е само за съединения, в които има елемент е невисша степен на окисление
- колкото повече кислород има, толкова повече се покачва степента на окисление на елемента с невисша такава
|Съединение|Реакция| |:--:|:--:|:--:| || (недостиг на кислород) (излишък от кислород)| || (голям недостиг на кислород) (среден недостиг на кислород) (излишък от кислород)|
-
Употреба
- горене
- производство на стомана
- рязане и заваряване на метали
-
Атомни характеристики
- III период, 16. (VIA) група
- малък атонен радиус
- висока йонизационна енергия - може само да приема електрони
- отрицателни йони
- степени на окисление: -II, -IV, -VI
-
Полиморфни форми
а) ромбична сяра
- жълто, твърдо вещество
- слаба миризма на кибрит
- при нагряване до 115°С и последвало охлаждане се получава моноклинна сяра
б) моноклинна сяра
- стабилна от 96-113°С
- прости ковалентни връзки между атомите
в) аморфна сяра
- рязко охлаждане на силно нагрявата сяра
- тъмнокафяв цвят
- като пластилин
- много нестабилна
-
Физични свойства
а) физични характеристики
- висока температура на кипене
- в газова фаза образува молекули от 2, 4 или 6 атома
б) разпространение
- като просто вещество - покрай вулканите
- под формата на руди - пирит (), сфалерит (), галенит (), халкопирит (), халкодит ()
- под формата на сероводород - в нефта и природния газ
в) получаване
- метод на Фраш - добив на природна сяра
-
Химични свойства - предимни окислител
а) окислителни свойства
- с метали и водород
б) редукционни свойства
-
Сероводород ()
а) физични свойства
- газ
- остра и неприятна миризма
- минерални извори
- отровен в големи количества
б) получаване
Реагенти Продукти Реакция неразтворим сулфид + разредена силна киселина в) химични свойства - много лесно се окислява
Реагенти Продукти Реакция метод на Клаус: - в разтвор - образува слаба сероводородна киселина
- хидроген сол в нормална сол - чрез добавяне на основа
-
Серен диоксид ()
а) физични свойства
- вулканичен газ
- остра и неприятна миризма
б) получаване
- промишлено - чрез пържене на руди или горене на сяра
в) химични свойства - киселинни
- и окислител, и редуктор
Взаимодействие Продукти Реакция с основни оксиди сулфит с основи сулфит + - с основи - силфит + H2O
- с основни оксиди - сулфит
г) приложение
- дезинфекционни и избелващи свойства
-
Серен триоксид ()
а) физични свойства
- летлива течност
- специфична миризма
б) получаване
- промишлено - контактно окисление на серен диоксид
в) химични свойства - киселинни
- само окислител
- с основни оксиди - сулфати
- с основи - сулфат + Х2О
-
Сериста киселина ()
а) физични свойства
- изключително нетрайна
- съществува само във воден разтвор
б) химични свойства
- дисоциация
- окисление
в) соли
- хидроген солите са термично нестабилни
-
Сярна киселина ()
а) физични свойства
- безцветна маслообразна течност - т.нар. концентрирана сярна киселина
- дими на въздуха
- нестабилно съединение
б) получаване
в) химични свойства
- много силен окислител
- силно хигроскопична - извлича влагата
- овъглява органични съединения
- разреждане - киселината се добавя към водата
- дисоциация
г) соли
- (глауберова сол) - медицина, производство на хартия
- (син камък)
- (зелен камък)
- (бял камък)
д) приложение
- производство на минерални торове
- пречистване на нефт от вода
- производство на лекарства и пластмаси
- акумулатори
- почистване на ръжда
е) производни на сярната киселина
- тиосулфати
- тиосярна киселина () - изключително нетрайна
- пероксимоносярна киселина - много силна киселина
- пероксидисярна киселина - много силни окислители
-
Място в периодичната таблица
- 17 (VIA) група - флуор, хлор, бром, йод
- характерно възбудено състояние - във всички без флуора
- малък атомен радиус
- голям брой електрони във външния електронен слой
- високи йонизационна енергия и електроотрицателност
- отлични окислители
- образуват само (халогенидни) йони
- високя химическа активност
-
Физични свойства
а) разпространение - само под формата на съединения
- флуор - (флуорит), (флуороапатит), (криолит)
- другите - в морската вода
б) физични характеристики
- флуор - бледожълт газ
- хлор - жълто-зелен газ
- бром - червено-кафява течност
- йод - тъмновиолетово твърдо вещество с метален блясък
- силно отровни
- отлична разтворимост в неполярни разтворители
- специфична миризма
в) приложение
- флуор - производство на фреони, тефлон, флуоридните йони предотвратяват кариеси
- хлор - производство на белина, дезинфекция на вода, органичен синтез
- бром - черно-бяла фотография
- йод - йодна тинктура, йодирана сол
-
Химични свойства
а) получаване
- флуор - получава се трудно
- хлор
- бром и йод - окисление на техните йони в разтвор на хлор
б) взаимодействия - изключително силни окислители
- флуор
Флуорът се пренася в медни или железни цилиндри, защото тези метали се пасивират във флуор.
- хлор
- йод
-
Съединения на халогените
а) интерхалогениди - свързване на халогени помежду си
- - силни окислители
б) халогеноводороди -
- безцветни газове
- силна разлика във физичните свойства
- инертни при обикновени условия
- висока реактивоспособност при нагряване
в) халогеноводородни киселини - разтваряне на халогеноводороди във вода
- доказване със сребърни йони - без флуороводородна киселина, защото сребърният флуорид е разтворим
- - единствената киселина, която разтваря стъкло; използва се за гравиране на стъкло; производство на фреони и криолит
- - стомашен сок
в) кислородни съединения - не реагират пряко с кислород
- оксиди - експлозивни
- - жълто-червен газ
- - жълт газ с активно избелващо действие
- - безцветна течност
- кислороден дифлуорид ()
г) оксокиселини - (хипо-иста), (-иста), (-на), (пер-на)
- флуорът образува само хипофлуориста киселина и то много трудно
, нетрайна, съществува само в разтвор най-силната неорганична киселина трайна под 90°С и концентрация 60% хипохлорити - нестабилни, окислително действие, белина хлорити - избелване на хартия хлорати - лабораторно получаване на кислород, силно избухливи перхлорати - изключително силни окислители
-
Атомни характеристики
- II период, 14. (IVA) група
- междинни стойности на йонизационната енергия
- трудно обрязва йони: (карбид)
- постоянна четвърта валентност
- добър редуктор, но може да е и окислител
- относително ниска химическа активност
-
Алотропни форми
а) природни
- диамант - атомна кристална решетка с тетраедри, хибридизация, много здрави ковалентни връзки; безцветно, много твърдо вещество, пречупващо светлината; не провежда ел. ток; топлопроводим; използва се в бижутерията и за режещи инструменти
- графит - атомна кристална решетка със слоеста структура от шестоъгълници, хибридизация, три сигма- и една делокализирана пи-връзка, обхващаща целия кристал; електропроводим, но с ниска топлопроводимост; черно-сиво, твърдо, мазно вещество с метален блясък; използва се за направата на електроди, средства за писане и за изработка на смазочни масла
- аморфен въглерод (видоизменен графит) - въглища, активен въглен, кокс
б) синтетични
- фулерени
- карбини
- въглеродни нанотръби
- графен
-
Разпространение и свойства
а) разпространение
- 19-ти по разпространение в земната кора
- образува милиони органични съединения
- среща се под формата на прости вещества - диамант, графит, въглища
- среща се под формата на съединения - нефт, природен газ, доломит, варовик, въглероден диоксид
б) химични свойства - слаба химическа активност, реагира само при нагряване; добър редуктор - отнема кислород от съединения
-
Съединения на кислород
а) въглероден оксид
- неутрален оксид - не реагира с вода, киселини и основи
- кръвна отрова
- продукт на горене при недостиг на кислород
- безцветен газ, без вкус и мирис, с маса почти колкото на въздуха
- получаване
- приложение - използва се като гориво, редуктор в металургията
б) въглероден диоксид
- киселинен оксид - реагира с вода, основи и киселини
- продукт на пълно изгаряне
- получаване
- безцветен газ, без вкус и миризма
- сравнително добра разтворимост във вода - газирани напитки
- при атмосферно налягане сублимира
- не гори и не поддържа горенето
- парников газ
- участва във фотосинтезата и дишането
- причината за естествената киселинност на световния океан
в) въглеродна киселина и солите й
- изключително слаба и нетрайна - съществува само във воден разтвор
- образува се при разтварянето на въглероден диоксид във вода
г) въглероден дисулфид (серовъглерод)
- безцветна течност с остра, неприятна миризма
- по-тежък от водата
- добър неполярен разтворител
- използва се за целофан
д) тетрахлорометан
- неполярна, тетраедрична молекула
- течност
- неполярен, апротонен разтворител
- използва се в химическото чистене
- канцерогенен
е) карбиди
- ацетилениди -
- метаниди -
ж) цианиди
- получаване
- силни основи
- циановодород - безцвете газ с миризма на горчиви бадеми; силно отровен (0,05 грама за фатални); използва се за получаването на полимери и пластмаси
-
Атомни характеристики
- II период, 15. (VA) груча
- високи йонизационна енергия, електроафинитет
- малък радиус
- трудно образува йони: (нитриди)
- много ниска реактивоспособност заради тройната връзка в азотната молекула
-
Разпространение, получаване и употреба
а) разпространение
- най-разпространеният газ в атмосферата - 78%
- в живите организми - аминокиселини, нуклинови киселини
- нагодища на селитри ()
б) получаване
- фракционна дестилация на въздуха
- лабораторно
в) употреба
- синтез на амоняк, азотна киселина и торове
- инертна среда - съхранявяне на документи и пакетиране на храни
- съхраняване на биологични проби
-
Свойства
а) физични
- бзцветен газ, без вкус и миризма
б) химични
- само с литий реагира при обикновени условия
-
Съединения
а) амоняк ()
- безцветен газ с остра и неприятна миризма
- пирамидална, полярна молекула
- сравнително лесно втечняване и замръзване (-33°С, -78°С)
- практически неограничена разтворимост на вода
- действа възбуждащо на нервната система
- продукт на гниене в отсъствие на въздух
- лабораторно получаване - амониева сол + алкална основа
- химични свойства - слаба основа със слаби киселинни свойства
- йони - (амид), (имид), (нитрид)
б) производни на амоняка
- хлорамин () - използва се за получаване на хидразин
- хидразин () - термично стабилно, но изключително реактивоспособно съединение; използва се като ракетно гориво
- хидроксиламин () - използва се в органичната химия
в) оксиди на азота
- диазотен оксид (, райски газ) - неутрален оксид; безцветен газ със сладникави миризма и вкус, действа упойващо
- азотен оксид () - безцветен газ с неприятна миризма; образува димери в твърдо и течно състояние
- диазотен триоксид () - киселинен оксид; светлосиня течност
- азотен диоксид () - смесен анхидрид; кафяво-червен газ (лисича опашка), отровен димеризира
- диазотен пентаоксид ()- киселинен оксид; бяло твърдо вещество, нестабилен
г) азотна киселина () - "силна вода"
- безцветна течност, мъгли на въздуха с червено-кафяви пари
- оставя трайни жълти петна по кожата
- много нетрайна
- при взаимодействие с метали никога не се отделя водород
д) нитрати
е) други съединения
- азотиста киселина () - слаба, нетрайна, съществува само във воден разтвор; има окислителни и редукционни свойства
-
Атомни характеристики
- III период, 15. (VA) група
- най-ниска електроотрицателност сред неметалите - може само да приема електрони
- йони: (фосфиди)
- променлива степен на окисленке: -3, 0, +3 и +5
- сравнително висока химическа активност
-
Алотропни форми
а) бял фосфор
- може да се превърне в червен фосфор при нагряване на 250°С в отсъствие на кислород
- молекулна кристална решетка
- бяло, восъкоподобно вещество
- разтворим в полярни разтворители
- самозапалва се при контакт с въздуха
- причинява изгаряния при допир с кожата
б) червен фосфор
- атомна кристална решетка - множество тетраедри, свързани в макромолекула
- химически инертен
- червено, прахообразно вещество
- неразтворим
- при нагряване сублимира, отделяйки
- запалва се при висока температура
-
Разпространение, приложение и получаване
а) разпространение - само под формата на съединения
- в живите организми - в костите, в мускулите, в зъбите, в нервите
- в яйца, в мляко и в зърнени култури
- минерали - (флуороапатит), (хидроксиапатит)
б) получаване
- редукция на калциев фосфат с кокс в присъствие на кварц
в) проложение
- производство на фосфорна киселина и фосфати
- получаване на сплави
- получаване на газирани напитки
-
Химични свойства - химически активен е белият фосфор
а) взаимодействие с активни метали
б) взаимодействие с неметали
-
Съединения
а) фосфороводород (, фосфин)
- не се получава при пряко взаимодействие
- получаване
- безцветен газ с остра неприятна миризма на развалена риба
- отровен
- при нагряване се разлага
- много слабо изразени основни свойства -> фосфониеви соли (нетрайни)
б) фосфан ()
- самозапалва се - блъждаещи огньове
в) халогениди
- фосфорен трихлорид () - тетраедричба структура; безцветна течност; използва се за получаване на киселините на фосфора
- фосфорен пентахлорид - твърдо, сламеножълто, кристално вещество; сублимира;
г) оксиди
-
дифосфорен триоксид () - бяло кристално вещество с остра миризма на чесън; димер; киселинен оксид
-
дифосфорен пентаоксид () - бяло, кристално вещество; димер; киселинен оксид; поглъща влагата
д) ортофосфорна киселина ()
- безцветно, твърдо вещество
- получаване
- средна по сила, трипротонна киселина
- термично нестабилна - участва в междумолекулна дехидратация
- употреба - получаване на торове, производство на лекарства, газирани напитки
д) кондензирани фосфорни киселини
- дифосфорна киселина ()
- трифосфорна киселина ()
- метафосфорна киселина ()
е) фосфориста киселина ()
- остра миризма на чесън
- получаване
- термично нестабилна
- слаба двупротонна киселина
ж) хинофосфориста киселина ()
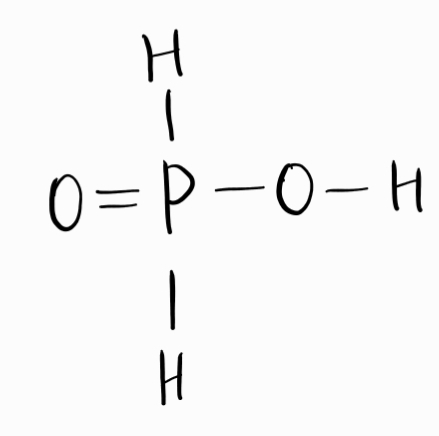
- монопротонна киселина
- получаване
-
Атомни характеристики
- IV период, 6. (VI Б) група
- незавършени последен и предпоследен електронен слой
- степени на окисление: +2 (основни съединения), +3 (амфотерни съединения), +6 (киселинни съединения)
-
Получаване
- не се среща в свободно състояние
- получава се от хромит () при редукция с кокс
- чист хром се получава при алуминотермия
-
Свойства
а) физични
- сребристобял
- метален блясък
- много твърд
- устойчив на корозия - пасивира се
-
Съединения - всичките са цветни, обичайно в ярки цветове
а) в +2 степен на окисление - много нетрайни, окисляват се на въздуха
- - син цвят; използва се за премахване на следи от кислород
- - неразтворим във вода, червена утайка
- - твърдо, черно вещество; основен оксид
- - неразтворим във вода, жълта утайка; бързо окисление на въздуха
б) в +3 степен на окисление
- - твърдо зелено вещество; най-стабилното съединение на хрома; амфотерен оксид; използва се като зелена боя
- - синьо-зелена утайкаю неразтворим във вода, но разтворим в киселини и основи; амфотерен хидроксид;
- - в силно разреден разтвор е виолетов (), а в концентриран разтвор е зелен ()
в) в +6 степен на окисление
- - киселинен оксид, разтворим във вода, нетраен отровен
- (хромена киселина) - нетрайна, съществува само в във воден разтвор, солите се наричат хромати
- (бихроматни йони) - много разтворими във вода, много добри окислители
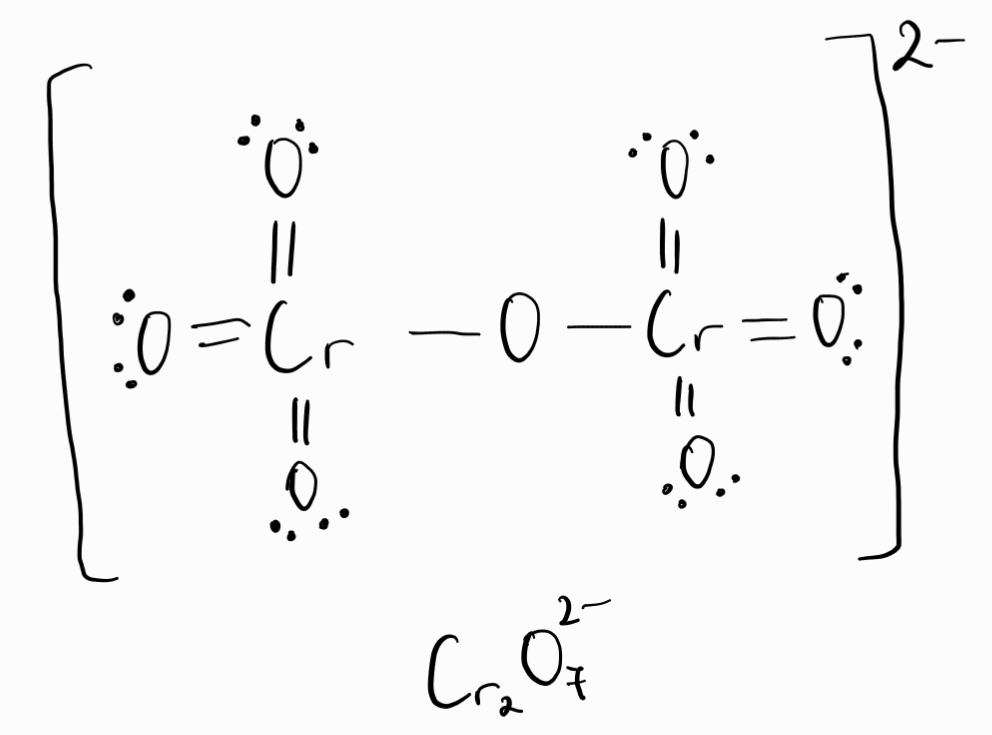
-
Приложения
а) на простото вещество
- сплави - нихром, хромел
- хромиване - нанасяне на неръждаемо покритие
- автомобилостроенето
б) на съединенията на хрома
- за бои
- фиксатори
- обработка на кожи
-
Атомни характеристики
- IV период, 7. (VIIБ) група
- степени на окисление: +2 (основни съединения), +3, +4, +6, +7 (киселинни свойства)
-
Получаване
а) разпространение
- пиролузит ()
-
Физични свойства
- сивобял метал с лек червен оттенък
- крехък
- окислява се на въздуха
- реагира бавно с вода и разредени киселини
-
Съединения
а) в +2 степен на окисление- е единственият стабилен йон на мангана в разтвор; бледорозов цвят
- разтворими соли -
- - розова утайка, окислява се на въздуха, разтваря се в амоняк, има основни свойства; термично нестабилен; получава се при утаяване на разтворима сол с алкална основа;
б) в +3 степен на окисление - нестабилни в разтвор; бързо се редуцира до
в) в +4 степен на окисление
- - амфотерен оксид, черно, прахообразно вещество; катализатор; термично нестабилен
г) в +6 степен на окисление - (манганати), стабилни само в основна среда
- (манганена киселина) - слаба, нетрайна, само в разтвор
д) в +7 степен на окисление - (перманганати)
- калиев перманганат () - твърдо виолетово вещество; розово-виолетов разтвор; дезинфектант; окислител
- перманганена киселина () - слаба, нетрайна, само във воден разтвор
- - тъмнокафява течност, силно експлозивен, киселинен оксид
-
Употреба
-
Атомни характеристики
- IV период, 8. (VIIIБ) група
- преходен метал
- степени на окисление: +2,+3
-
Разпространение
- втори по разпространение от металите в земната кора
- четвърто място по разпространение от всички елементи в земната кора
- изгражда земното ядро
- изгражда огромна част от метеоритите
- съдържа се в кръвта
- руди - магнетит (), хематит (), лимонит (), сидерит ()
-
Употреба
- най-употребяваният метал
- под формата на сплави

-
Полиморфни форми
а) делта-желязо
б) гама-желязо
- стенноцентрирана кристална решетка
- разтваря значително количество въглерод
в) алфа-желязо
- обемноцентрирана кристална решетка
-
Желязо-въглеродна структури
а) ферит - твърд разтвор на въглерод в
- най-бедната на въглерод структура (<0,02% въглерод)
б) аустенит - твърд разтвор на въглерод в
- до 2,14% въглерод
в) циментит () - химично съединение между желязото и въглерода
- кристализира при охлаждане на останалите структури
г) перлит - механична смес от ферит и вторичен циментит
- основна съставна част на стоманата
- около 0,8% въглерод
д) ледебурит - механична смес от аустенит и първичен циментит
- основна съставна част на чугуна
- около 4,3% въглерод
-
Свойства
а) физични
- сребристобяло, твърдо вещество
- ковко, разтегливо, пластично вещество
- сравнително меко
- магнитни свойства
б) химични
- разтваря се в разредени киселини
- пасивира се от концентрирани оксокиселини
- на влажен въздух корозира
-
Съединения на желязото
а) в +2 степен на окисление (феро съединения)
- - черно, твърдо вещество; основни свойства
- - амфотерен с по-изразени основни свойства; неразтворим във вода; бяла утайка, нетрайна на въздуха
- , , - разтворими във вода феросоли
- - неразтворими във вода
- фероцианид ()
- (жълта кръвна сол) - изключителна стабилност, консервант на колбаси, вино и други
б) в +3 степен на окисление (фери съединения)
- - амфотерен оксид; червено прахообразно вещество
- - червено-кафяво, неразтворимо във вода вещество; амфотерен хидроксид
- - ковалентно съединение; добра разтворимост във вода с жълто-кафяво-оранжев цвят във разтвор; лекарство за анемия, кръвоспиращо средство
- (червена кръвна сол) - използва се за пиротехника, производство на циановодород
-
Атомни характеристики
- IV период, 11. (IБ) група
- степени на окисление: +1, +2 (амфотерни съединения с много преобладаващи основни свойства)
-
Разпространение
а) в чист вид - много рядко
б) в руди и минерали - халкопирит (), халкозин (), куприт (), малахит ()
-
Употреба
- вторият най-употребяван метал след желязото
- изработка на проводници
- сплави - месинг (мед + цинк), бронз (мед + калай), алпака (мед + цинк + никел), дураломиний (мед + алуминий)
-
Свойства
а) физични
- червено-оранжев цвят
- лесна обработка, ковък и разтеглив метал
- метален блясък
- изключителна електропроводимост (но само при много голяма чистота)
- тежък метал
б) химични - много ниска химическа активност
- пасивира се на въздуха - първо потмнява, после се покрива със синьо-зелен слой (медна патина - карбонат + хидроксид)
- реагира само с концентрирани оксокиселини
- не реагира с основи
- реагира с неметали при нагряване
-
Съединения на медта
а) в +1 степен на окисление
- - червен цвят; корабна боя
- - жълта утайка, съществуваща само във водна среда
- трудно получаване на едновалентни соли
-
Клетка на Даунс - производство на натрий и хлор
а) суровини
- - понижава температурата на топене на сместа от 800°С до 580°С
б) процес - електролиза на стопилка на
б) разходи - 25000A до 40000А
-
Хлор-алкална електролиза - производство на водород, хлор и алкална основа
а) суровини
- матерна луга (силно концентриран разтвор на )
- чиста вода
б) процес
-
Метод на Хол-Еру - производство на алуминий
а) суровини
- (от боксит)
- криолит () - понижава температурата на топене от 2045°С до 1000°С и играе ролята на електролит
б) процес - не е напълно известен
- в процеса се образува газ кислород, който реагира с графитените аноди до получаване на въглероден диоксид, което означава, че анодите трябва често да се подменят
в) разходи - 250 000А